
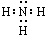 ;氮气与氧气在雷电的作用下发生反应生成一氧化氮,方程式为:N2+O2
;氮气与氧气在雷电的作用下发生反应生成一氧化氮,方程式为:N2+O2
| ||
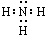 ;N2+O2
;N2+O2
| ||
| ||
| ||
| 11.2L |
| 22.4L/mol |
| 11.2L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、液氨汽化时要放出大量的热,可用作制冷剂 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、氧化铝是一种电解质,可用于制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
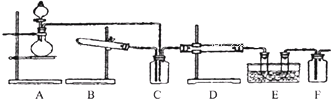
查看答案和解析>>
科目:高中化学 来源: 题型:
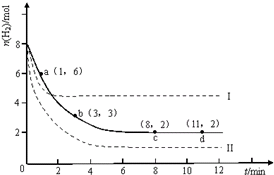 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| A、减少O2的浓度能加快反应速率 |
| B、降低体系温度能加快反应速率 |
| C、使用催化剂不影响反应速率 |
| D、一定条件下达到反应限度时SO2部分转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离产生的c(OH-)=10-12mol?L-1 | ||
| B、向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) | ||
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和等物质的量的HCl | ||
D、用水稀释时,溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5又称细颗粒物,是指空气动力学当量直径小于等于2.5微米的颗粒物.因其粒径小,面积大,活性强,易附带有毒、有害物质(例如,重金属、微生物等),对人体健康和大气环境质量的影响更大 |
| B、“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用,生成了可溶性的Ca(HCO3)2 |
| C、食品安全已成为各地政府和公众关注的热点话题,严禁向食品中添加任何非食用物质和滥用食品添加剂 |
| D、一氧化碳有毒,生有煤炉的居室,可放置数盆水,这样可有效地吸收一氧化碳,以防煤气中毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com