
| A. | 分子中C、H、O的原子个数之比一定为1:4:4 | |
| B. | 一定为烃类 | |
| C. | 分子中一定含有氧原子 | |
| D. | 分子式为CH4Ox(x=0、1) |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
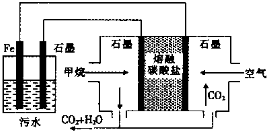
| A. | 左侧装置中的铁电极可换成石墨电极 | |
| B. | 通入甲烷的石墨电极的电极反应式为:CH4+4CO32--8e-═5CO2+2H2O | |
| C. | 通入空气的石墨电极做正极,发生氧化反应 | |
| D. | 若左侧装置中石墨电极产生标准状况下气体44.8L气体,则消耗2mol甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
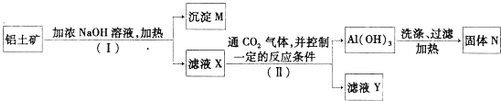
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2、KOH、CaO | B. | CO、NaOH、KCl | C. | H2O、H2SO4、NaCl | D. | CuO、Na2O2、CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古铜币上出现铜绿[Cu2(OH)2CO3] | B. | 铝制用品表面变暗 | ||
| C. | 钢铁生锈 | D. | 氢氧化钠固体潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
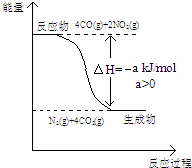 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
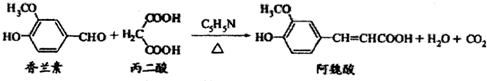
| A. | 1mol阿魏酸与足量溴水反应,消耗1molBr2 | |
| B. | 香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、水解反应 | |
| D. | 香兰素与足量氢气完全反应后的产物,其1个分子中含有3个手性碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com