
(16分)
Ⅰ.下面是s能级p能级的原子轨道图,试回答问题:
s电子的原子轨道呈 形,每个s能级有 个原子轨道;p电子的原子轨道呈 形,每个p能级有 个原子轨道。
Ⅱ.写出下列元素基态原子的电子排布式:
(1)Ca (2)Kr
(3)Co (4)Ge
科目:高中化学 来源: 题型:

| 1600a-25b |
| 16a |
| 1600a-25b |
| 16a |
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)
有五瓶损坏标签的试剂,分别盛有硫酸溶液、氢氧化钾溶液、硝酸钡溶液、碳酸氢钠溶液、氯化铜溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E。观察发现,C试剂颜色为蓝色,其余为无色;四种无色试剂A、B、D、E用小试管各取少量,两两相互滴加,反应现象为:A与其余三种混合无明显现象,B与D出现白色沉淀,B与E无明显现象,D与E混合有气泡产生;A与C混合有蓝色沉淀。由此,可判定各试剂瓶中所盛试剂为(用主要成分的化学式表示):
A____________,B____________,C____________,D____________,E____________。
另外,请写出下面的离子方程式:
(1)B与D:_____________________________________________。
(2)D与E:______________________________________________。
(3)A与C:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010年福建省厦门外国语学校高三模拟考试(理综)化学部分 题型:填空题
(16分)应用化学反应需要研究化学反应的条件、限度和速率。
(1)已知反应:Br2+2Fe2+=2Br-+2Fe3+,向10 mL 0.1 mol·L-1的FeBr2溶液中通入0.001 mol Cl2,反应后,溶液中除含有Cl-外,还一定有 (填序号)。
①含Fe2+,不含Fe3+②含Fe3+,不含Br-③含Fe3+,还含有Br-
(2)773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
①若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③下列与催化剂有关的说法中,正确的是 (填字母序号)。
a. 使用催化剂,使反应CO(g)+2H2(g) CH3OH(g) ΔH>-91 kJ·mol-1
CH3OH(g) ΔH>-91 kJ·mol-1
b. 使用催化剂, 能够提高反应物转化率
c. 使用催化剂,不能改变反应的平衡常数K
(3)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
① Ni作 (填“阴”或“阳”) 极;
②Ni电极的电极反应式为: 。
。
(4)氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:NO-3+4H++3e-→NO+2H2O
①KMnO4、HCl、Fe(NO3)2、CuO、KI五种物质中的 (填化学式)能使上述还原过程发生。
②欲用下图装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定 推(计)算反应速率。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省商丘市高三第二次模拟考试(理综)化学部分 题型:填空题
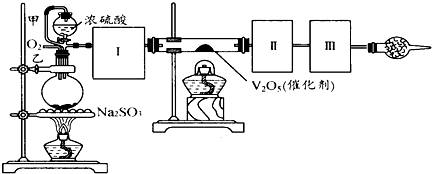
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是 16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+H2SO4(80%)  Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
【注:80%H2SO4具有浓硫酸的特性】
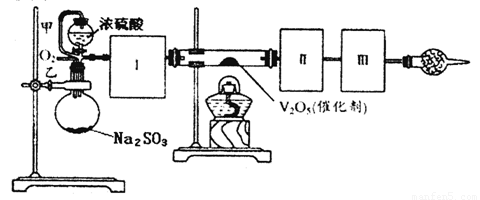
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~D装置中选择最合适的装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是___________、_____________、_____________。
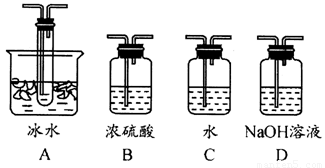
(2)在实验中“加热催化剂”与“滴加浓硫酸”的操作,首先应采取的操作是___________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法。
①原因__________________________________________________.
验证方法________________________________________________.
②原因__________________________________________________.
验证方法________________________________________________.
(4)将足量SO2通入含1.0mol次氯酸的溶液中,有1.204×1024个电子转移,生成两种强酸,该反应的化学方程式为______________________________。
(5)用25.2gNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间将反应产生的SO2全部排出,测得装置Ⅲ增重了3.2g,则SO2的转化率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com