
【题目】下列芳香族化合物之间的转化关系如下:
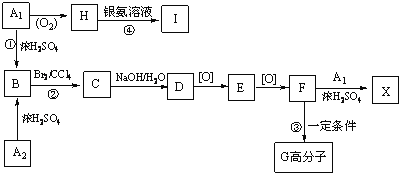
已知:A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的59倍,B苯环上的一氯取代物有三种。
请结合上述信息回答:
(1)A2中所含官能团的名称为_______,B的结构简式为_________ ; G____________。反应C→D属于_______反应(填反应类型)。
(2)写出F→X反应的化学方程式_____________________________________;H→I反应的化学方程式____________________________________.
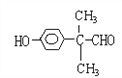
(3)化合物J是比化合物E多一个碳原子的E的同系物,化合物J有多种同分异构体,写出满足下列条件且核磁共振氢谱图中峰面积比为1:1:2:2:6的同分异构体的结构简式_______________任写一种即可)。
①苯环上有两个取代基 ②能使FeCl3溶液显色 ③与E含有相同官能团
【答案】 羟基 ![]()
 取代
取代 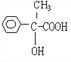 +
+![]()
![]()
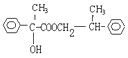 +H2O
+H2O 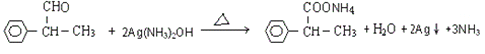
【解析】试题分析:本题考查有机物分子式的确定,有机推断,官能团的识别,有机反应类型的判断,有机物结构简式和有机方程式的书写,限定条件同分异构体的书写。H能发生银镜反应,H中含—CHO,A1发生氧化反应生成H,A1中含—CH2OH,A1和浓硫酸在一定温度下共热发生消去反应生成烃B,B中含![]() ;B的蒸气密度是同温同压下H2密度的59倍,B的相对分子质量为59
;B的蒸气密度是同温同压下H2密度的59倍,B的相对分子质量为59![]() 2=118,B属于烃,用“商余法”:
2=118,B属于烃,用“商余法”:![]() =9…10,烃B的分子式为C9H10,B的不饱和度为5,B的苯环上一氯取代物有三种,B只有一个侧链;A1、A2分别和浓硫酸在一定温度下共热发生消去反应都只生成烃B,则A1的结构简式为
=9…10,烃B的分子式为C9H10,B的不饱和度为5,B的苯环上一氯取代物有三种,B只有一个侧链;A1、A2分别和浓硫酸在一定温度下共热发生消去反应都只生成烃B,则A1的结构简式为![]() ,A2的结构简式为
,A2的结构简式为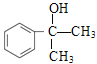 ,B的结构简式为
,B的结构简式为![]() ;A1发生氧化反应生成H,H的结构简式为
;A1发生氧化反应生成H,H的结构简式为![]() 。B与Br2/CCl4发生加成反应生成C,C的结构简式为
。B与Br2/CCl4发生加成反应生成C,C的结构简式为![]() ;C与NaOH/H2O发生水解反应生成D,D的结构简式为
;C与NaOH/H2O发生水解反应生成D,D的结构简式为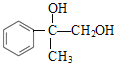 ;D→E→F为两步氧化,E的结构简式为
;D→E→F为两步氧化,E的结构简式为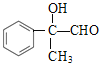 ,F的结构简式为
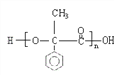
,F的结构简式为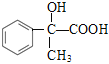 ;F中含—COOH和—OH,F在一定条件下发生缩聚反应生成高分子化合物G,G的结构简式为
;F中含—COOH和—OH,F在一定条件下发生缩聚反应生成高分子化合物G,G的结构简式为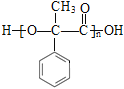 。
。
(1)A2的结构简式为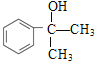 ,A2所含官能团名称为羟基。B的结构简式为
,A2所含官能团名称为羟基。B的结构简式为![]() 。G的结构简式为
。G的结构简式为 。C→D为溴代烃在NaOH/H2O中发生取代反应。
。C→D为溴代烃在NaOH/H2O中发生取代反应。
(2)F+A1发生酯化反应生成X,反应的化学方程式为 +
+![]()
![]()
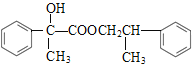 +H2O。H→I为银镜反应,反应的化学方程式为
+H2O。H→I为银镜反应,反应的化学方程式为![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +2Ag↓+3NH3+H2O。
+2Ag↓+3NH3+H2O。
(3)E的结构简式为 ,E中的官能团为羟基和醛基,E的分子式为C9H10O2,化合物J是比化合物E多一个碳原子的E的同系物,J的分子式为C10H12O2;J的同分异构体能使FeCl3溶液显色,J的同分异构体中含酚羟基;J的同分异构体与E含有相同官能团,J的同分异构体中含羟基和醛基;符合条件的苯环上有两个取代基且核磁共振氢谱图中峰面积比为1:1:2:2:6的同分异构体的结构简式为
,E中的官能团为羟基和醛基,E的分子式为C9H10O2,化合物J是比化合物E多一个碳原子的E的同系物,J的分子式为C10H12O2;J的同分异构体能使FeCl3溶液显色,J的同分异构体中含酚羟基;J的同分异构体与E含有相同官能团,J的同分异构体中含羟基和醛基;符合条件的苯环上有两个取代基且核磁共振氢谱图中峰面积比为1:1:2:2:6的同分异构体的结构简式为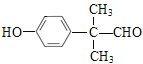 。
。


科目:高中化学 来源: 题型:
【题目】一定条件下,某容器中各微粒在反应前后变化示意图如下,其中“o”和“●”代表不同元素的原子。下列关于此反应不能得出的结论是:

A. 该反应可表示为![]()
B. 可能是PC15的分解反应
C. 反应过程中,一定伴随共价键的断裂与形成
D. 该反应的△H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量![]()
Ⅰ![]() 实验步骤
实验步骤
(1)配制100mL待测白醋溶液:用 ______ ![]() 填仪器名称
填仪器名称![]() 量取
量取![]() 市售白醋,在烧杯中用水稀释后转移到 ______
市售白醋,在烧杯中用水稀释后转移到 ______ ![]() 填仪器名称
填仪器名称![]() 中定容,摇匀即得待测白醋溶液.
中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液![]() 于锥形瓶中,向其中滴加2滴 _____ 作指示剂.
于锥形瓶中,向其中滴加2滴 _____ 作指示剂.
(3)读取盛装![]() NaOH溶液的碱式滴定管的初始读数
NaOH溶液的碱式滴定管的初始读数![]() 如果液面位置如图所
如果液面位置如图所![]() 示,则此时的读数为 ______ mL.
示,则此时的读数为 ______ mL.
(4)滴定![]() 当 ______ 时,停止滴定,并记录NaOH溶液的终读数
当 ______ 时,停止滴定,并记录NaOH溶液的终读数![]() 重复滴定3次.
重复滴定3次.
(5)实验记录
滴定次数实验数据 | 1 | 2 | 3 | 4 |
|
|
|
|
|
|
|
|
|
|
Ⅲ![]() 数据处理与讨论
数据处理与讨论
按实验所得数据,可得![]() 市售白醋
市售白醋![]() ______
______ ![]() ;市售白醋总酸量
;市售白醋总酸量![]() ______
______ ![]() .
.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是 ______ (填写序号![]() .
.
![]() 碱式滴定管在滴定时未用标准NaOH溶液润洗
碱式滴定管在滴定时未用标准NaOH溶液润洗
![]() 碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
![]() 锥形瓶中加入待测白醋溶液后,再加少量水
锥形瓶中加入待测白醋溶液后,再加少量水
![]() 锥形瓶在滴定时剧烈摇动,有少量液体溅出.
锥形瓶在滴定时剧烈摇动,有少量液体溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.石油是混合物,分馏后的馏分是纯净物B.乙烯是石油裂化的主要产品
C.石油的裂化是化学变化,分馏是物理变化D.减压蒸馏可以得到汽油等轻质油
查看答案和解析>>
科目:高中化学 来源: 题型:
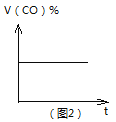
【题目】下列关于化学反应的图像的说法不正确是 ( )
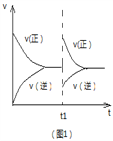
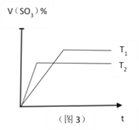
A. 图1可表示反应2NO2![]() N2O4 在等温等压条件下平衡后t1时刻充入NO2时反应速率变化
N2O4 在等温等压条件下平衡后t1时刻充入NO2时反应速率变化
B. 图2可表示CO(g)+2H2(g)![]() CH3OH(g)在一定温度下,将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生反应时CO的体积分数随时间变化图像。
CH3OH(g)在一定温度下,将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生反应时CO的体积分数随时间变化图像。
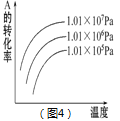
C. 图3可表示反应2SO2 +O2![]() 2SO3 ,温度T1>T2,反应为吸热反应。
2SO3 ,温度T1>T2,反应为吸热反应。
D. 图4可表示反应mA(g)+nB(g)![]() pC(g)+qD(g),正反应是吸热反应,且m+n>p+q。
pC(g)+qD(g),正反应是吸热反应,且m+n>p+q。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.在常温、常压下,11.2 L N2含有的分子数为0.5 NA
B.标准状况下,22.4 L H2和O2的混合物所含分子数为NA
C.标准状况下,18 g H2O的体积是22.4 L
D.1 mol SO2的体积是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,食品添加剂、感光剂等。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。回答下列问题:
(1)水合肼的制备
有关反应原理为:NaClO+2NH3=N2H4·H2O+NaCl。
①用下图装置制取水合肼,其连接顺序为_________(按气流方向,用小写字母表示)。
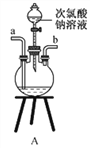
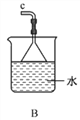
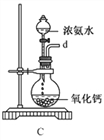

②装置C中发生反应的化学方程式为_____________________,装置D的作用是__________________。
(2)碘化钠的制备
步骤一:向三口烧瓶中加入8.2gNaOH及30mL水,搅拌冷却,加入25.4g单质碘,开动磁力搅拌器,保持60~70℃至反应充分;
步骤二:继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的某气体;
步耀三:向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
步骤四:将步骤三分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.3g。
①步骤一反应温度不宜超过70℃的原因是________________________;该步骤反应完全的现象是_______________________________。
②步骤二中IO-参与反应的离子方程式为_______________________________。
③步骤三“将溶液与活性炭分离”的方法是_____________________________。
④本次实验产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
A. x的值为2 B. A的转化率为60%
C. B的平衡浓度为0.8 mol/L D. D的体积分数为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列设计的实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1molLFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5ml.0.1mo/L的KMnO4溶液,分别加入2mL0.1mol/L和10.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间 |
C | 证明海带中含有碘元素 | 将海带剪碎、加蒸馏水浸泡,取滤液加几滴稀硫酸和1mLH2O2,再加入几滴淀粉溶液,溶液变蓝 |
D | 验证CH3COONa 溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com