
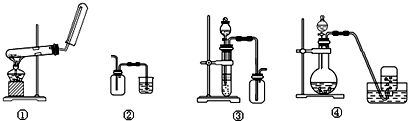
| A. | 装置①:用氯化铵和氢氧化钙制NH3 | B. | 装置②:收集NO气体 | ||
| C. | 装置③:用锌粒和稀硫酸制H2 | D. | 装置④:用双氧水和二氧化锰制O2 |
分析 A.氯化铵和氢氧化钠反应生成水,应防水倒流;
B.NO不能利用排空气法收集;
C.氢气的密度比空气的密度小;
D.H2O2分解生成水和氧气,二氧化锰作催化剂,氧气不溶于水.
解答 解:A.氯化铵和氢氧化钠反应生成水,应防水倒流,则加热的试管口应略向下倾斜,故A错误;
B.NO不能利用排空气法收集,图中收集方法不合理,应利用排水法收集,故B错误;
C.氢气的密度比空气的密度小,图中收集方法不合理,导管应短进长出,故C错误;
D.H2O2分解生成水和氧气,二氧化锰作催化剂,氧气不溶于水,则图中固液反应不加热装置及排水法收集装置均合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及常见气体的制备实验、气体的收集等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | NaH2PO4═Na++H2PO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 2:3 | C. | 3:1 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 操作及现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度: CO32->HCO3- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
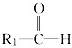 和
和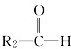 ;
; 被氧化为
被氧化为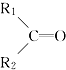 和
和 ,由此推断分子式为C5H10的烯烃的氧化产物有( )
,由此推断分子式为C5H10的烯烃的氧化产物有( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中混有的少量苯酚:加入适量浓溴水,振荡、静置后过滤 | |
| B. | 实验室制备乙酸丁酯:水浴加热 | |
| C. | 分离乙酸乙酯和饱和碳酸钠溶液:分液 | |
| D. | 检验FeCl3溶液中是否含有Fe2+:取少量溶液先滴加氯水,再滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3 | B. | C(OH-)=10-8mol/l | C. | pH=11 | D. | C(H+)=10-4mol/l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com