
| A. | NaHRO3溶液中(R表示S或C):c(Na+)>c(HRO3-)>c(OH-)>c(H+)>c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② | |
| D. | 等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数:N前>N后 |
分析 A.NaHSO3溶液中HSO3-电离程度大于其水解程度,但NaHCO3溶液中HCO3-电离程度小于其水解程度;
B.醋酸钠溶液呈碱性,要使醋酸钠、盐酸两溶液混合后呈中性,则醋酸钠浓度要远远大于盐酸浓度,溶液中溶质为氯化钠、醋酸钠和醋酸,结合物料守恒判断;
C.碳酸根离子促进铵根离子水解、亚铁离子促进铵根离子水解,铵根离子水解程度越大溶液中铵根离子浓度越小;
D.HClO是弱酸,所以NaClO溶液中发生水解反应:ClO-+H2O?HClO+OH-,使溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中C(Na+)+C(H+)大于NaClO溶液中C(Na+)+C(H+),依据电荷守恒分析.
解答 解:A.NaHSO3溶液中HSO3-电离程度大于其水解程度,但NaHCO3溶液中HCO3-电离程度小于其水解程度,所以亚硫酸氢钠中存在c(OH-)<c(H+),碳酸氢钠中存在c(OH-)>c(H+),故A错误;
B.醋酸钠溶液呈碱性,要使醋酸钠、盐酸两溶液混合后呈中性,根据电荷守恒得c(Na+)=c(Cl-)+c(CH3COO-),则c(Na+)>c(Cl-),醋酸钠浓度要远远大于盐酸浓度,溶液中溶质为氯化钠、醋酸钠和醋酸,根据物料守恒得c(Na+)=c(CH3COOH)+c(CH3COO-),所以c(Cl-)=c(CH3COOH),故B错误;
C.碳酸根离子促进铵根离子水解、亚铁离子促进铵根离子水解,铵根离子水解程度越大溶液中铵根离子浓度越小,所以三种溶液中c(NH4+):①<②<③,故C错误;
D.HClO是弱酸,所以NaClO溶液中发生水解反应:ClO-+H2O?HClO+OH-,使溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中C(Na+)+C(H+)大于NaClO溶液中C(Na+)+C(H+),根据电荷守恒:C(Na+)+C(H+)=C(OH-)+c(Cl-)可得溶液中离子总数为2×[c(Na+)+c(H+)]×V;同理可得NaClO溶液中总数为2×[c(Na+)+c(H+)]×V,所以NaCl溶液中离子总数大于NaClO溶液,故D正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,注意熟练利用电荷守恒、物料守恒等解决问题,难点是确定溶液中溶质及其性质,易错选项是B.


科目:高中化学 来源: 题型:解答题
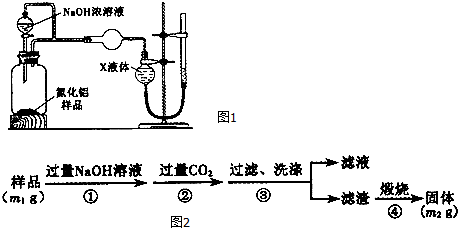
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
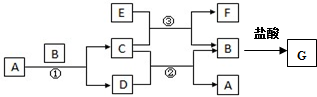
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )
25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )| A. | 溶液的pH | B. | 水解平衡常数 | ||
| C. | 水解百分率 | D. | 溶液中阴离子浓度之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| B. | 在pH=2的溶液中:NH4+、K+、ClO-、Cl- | |
| C. | 在c(H+)/c(OH-)=10-12的溶液中:K+、Na+、C1O-、NO3- | |
| D. | 水电离c(H+)=10-12的溶液中:Mg2+、Cu2+、SO42+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气凝结为液态的水 | B. | 氨气和氯化氢反应生成氯化铵晶体 | ||
| C. | 碳酸氢铵在常温情况下分解 | D. | CO点燃时生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
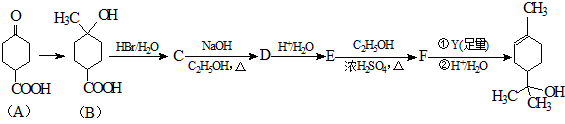
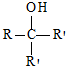
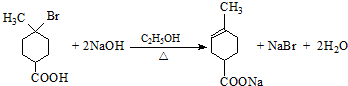 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com