
【题目】进行实验时应高度重视实验安全,下列操作符合实验安全要求的是( )
A.金属钠若着火用水扑灭B.加热时,试管口不对着自己或他人
C.浓NaOH溶液沾到手上立刻用盐酸冲洗D.灼烧样品后的坩埚直接放在冷水中降温
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
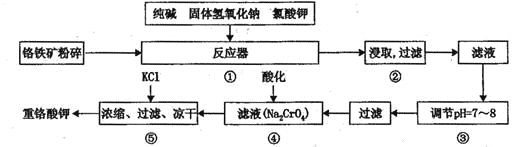
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:_______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现以下各步转化,请写出括号内应加入的试剂。
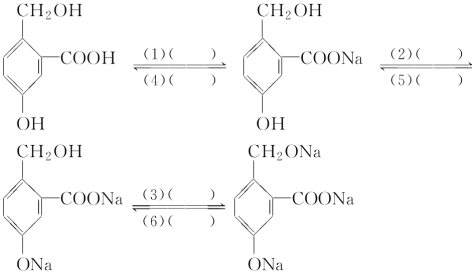
(1)________________;
(2)________________;
(3)________________;
(4)________________;
(5)________________;
(6)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等浓度的FeSO4和(NH4)2SO4两种浓溶液混合可制得一种晶体,该晶体(称摩尔盐)是分析化学中常用的一种还原剂,其强热分解反应化学方程式:2(NH4)2Fe(SO4)2·6H2O![]() Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O。下列说法正确的是( )
Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O。下列说法正确的是( )
A. 该反应中氧化产物是N2、NH3,还原产物是SO2、Fe2O3
B. 1mol摩尔盐强热分解时转移电子的物质的量为8NA
C. 向摩尔盐溶液中滴入足量浓NaOH溶液,最终可得刺激性气体和红褐色沉淀
D. 常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)本实验中制取次氯酸钠的离子方程式是_______________________。
(3)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 | 原因 |
溶液最初从紫色逐渐变为___________色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 | ___________________________ |
然后溶液从无色逐渐变为_________色 | ____________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
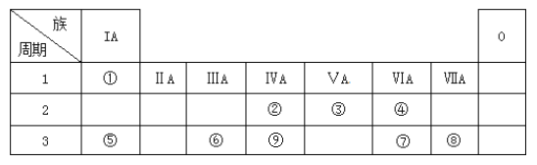
(1)第三周期中元素非金属性最强的元素的原子结构示意图为__________。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)_____________。
(3)用电子式表示④的氢化物的形成过程_________________________。
(4)下列可以判断⑤和⑥金属性强弱的是__________。
a. ⑤单质的熔点比⑥单质低
b. ⑤的化合价比⑥低
c. ⑤单质与水反应比单质⑥剧烈
d. ⑤最高价氧化物的水化物的碱性比⑥强
(5)由表中①、③、④、⑥、⑧元素形成的常见物质Z、M、N可发生以下反应:
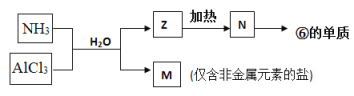
a. M中所含的化学键种类为(若含共价键,请标明极性或非极性)_________。
b. N→⑥的单质的化学方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种短周期元素的原子序数依次增大。A、D同族;B、C同周期。A、B组成的化合物甲为气态,其中A、B原子个数之比为4:1。常温下,由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子个数比为1:1;丙中A、C原子个数比为2:1。由D和C组成的两种化合物丁和戊都为固态,丁中D、C原子个数之比为1:1;戊中D、C个数比为2:1。B元素的最高价氧化物跟丁能发生化学反应,生成物为两种,其中一种为C的单质。
(1)写出对应物质的化学式①乙_______;②丁_______。
(2)B元素的最高价氧化物跟丁反应的化学方程式_______。
(3)写出下列物质的电子式①甲_______;②戊_______。
(4)A、B、C、D4种原子的半径由大到小顺序______(填元素符号)。
(5)由A、B、C、D4种原子组成的既含离子键又含共价键的物质的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe 四种金属元素组成,回答下列问题:
(1)基态Fe原子有_______个未成对电子,Fe3+的价电子排布式为__________。
(2)新制的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙醛分子中含有的σ键与π键的比例为___。乙醛中碳原子的杂化轨道类型为_____,配合物[Cu(NH3)4](OH)2中含有的化学键类型有_________,1 mol该物质中有______个σ键。
(3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(4)CaCl2熔点高于AlCl3的原因__________________________________。
(5)CaF2晶胞如图所示,已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏加德罗常数的值。氟化钙晶体中Ca2+和F-之间最近核间距(d)为______________pm(只要求列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com