
| A. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| B. | 用食醋和澄清石灰水验证蛋壳中含碳酸盐 | |
| C. | 直接往淀粉水解液中滴入银氨溶液可产生银镜 | |
| D. | 用分液漏斗分离溴和苯 |
分析 A.乙醇和乙酸的反应为可逆反应;
B.醋酸与碳酸盐反应生成二氧化碳气体;
C.淀粉在酸性条件下水解生成葡萄糖,葡萄糖发生银镜反应在碱性条件下;
D.溴和苯混溶.
解答 解:A.乙醇和乙酸的反应为可逆反应,用乙醇和浓硫酸不能除去乙酸乙酯中的少量乙酸,并引入了新的杂质,可加入生石灰后蒸馏,故A错误;
B.醋酸呈酸性,且酸性比碳酸强,可与碳酸盐反应生成二氧化碳气体,然后用澄清石灰水检验,故B正确;
C.淀粉在酸性条件下水解生成葡萄糖,葡萄糖发生银镜反应在碱性条件下,水解后应先加入碱调节溶液呈碱性,故C错误;
D.溴和苯混溶,应用蒸馏的方法分离,故D错误.
故选B.
点评 本题考查了化学实验方案评价,明确实验原理是解本题关键,根据物质的性质来分析解答,易错选项是A,根据乙酸乙酯的制取实验确定除杂剂,题目难度中等.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:实验题
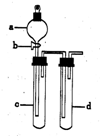 某兴趣小组设计出如图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方 案 | 反 应 物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸能与水以任意比例混溶 | B. | 醋酸能与碳酸钠反应 | ||
| C. | 醋酸能使紫色石蕊试液变红色 | D. | 0.1mol.L-1醋酸溶液pH=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
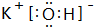 ②HClO的结构式H-O-Cl
②HClO的结构式H-O-Cl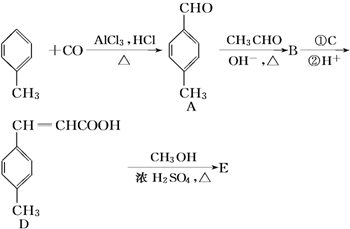
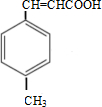 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$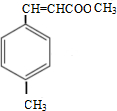 +H2O
+H2O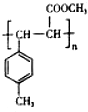 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式: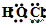 | |
| B. | 质子数为6、质量数为14的原子:${\;}_6^{14}N$ | |
| C. | CS2的结构式:S=C=S | |
| D. | 氯的原子结构示意图: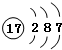 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L氟化氢中含有分子的数目为0.5NA | |
| B. | 常温下a克某烷烃(CnH2n+2)中含有共用电子对数目为$\frac{a}{14n+2}$(3n+1)NA | |
| C. | 56g 聚乙烯中含有碳碳双键的数目为2NA | |
| D. | 常温下,0.2mol/L的FeCl3溶液中含Cl-数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| t/℃ | 700 | 800 | 830 | 1000 |
| K | 20 | 10 | 1.0 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com