
 .
. .
.分析 A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D,B的气态氢化物的分子式为H2B,则B是第ⅥA族元素,最高价是+6价,即最高价氧化物是BO3,设B的质子数是x,则$\frac{2x}{2x+48}$=40%,解得x=16,所以B是S元素;C和A、B在同一周期,即处于第三周期,B与A左右相邻,则A为Cl;D和A形成简单离子后,它们电子层相差两层,而n-m=6,所以m=1,则D是Li元素;C和A可形成CA3型化合物,且C的原子序数小于B的,结合(5)中能与盐酸反应,则C应该是Al元素,据此解答.
解答 解:A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D,B的气态氢化物的分子式为H2B,则B是第ⅥA族元素,最高价是+6价,即最高价氧化物是BO3,设B的质子数是x,则$\frac{2x}{2x+48}$=40%,解得x=16,所以B是S元素;C和A、B在同一周期,即处于第三周期,B与A左右相邻,则A为Cl;D和A形成简单离子后,它们电子层相差两层,而n-m=6,所以m=1,则D是Li元素;C和A可形成CA3型化合物,且C的原子序数小于B的,结合(5)中能与盐酸反应,则C应该是Al元素.
(1)若n-m=6,则A与D形成化合物是LiCl,属于离子化合物,电子式为 ,
,
故答案为: ;
;
(2)D位于第二周期第m族,所以原子序数是m+2,故答案为:m+2;
(3)Al3+离子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)向H2S的水溶液中滴入氯气的水溶液,发生反应的化学方程式为:H2S+Cl2=S↓+2HCl,
故答案为:H2S+Cl2=S↓+2HCl;
(5)向HCl的水溶液中投入Al的单质,反应的离子方程式为:2Al+6H+=2Al3++3H2↑,
故答案为:2Al+6H+=2Al3++3H2↑.
点评 本题考查结构性质位置关系应用,关键是推断元素,注意根据问题确定C为Al,属于中等难度的试题,侧重对基础知识的巩固与检验,有利于培养学生的逻辑思维能力和发散思维能力.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:解答题
 +CH3COCHCOOC2H5$→_{10℃搅拌12h}^{浓H_{2}SO_{4}}$
+CH3COCHCOOC2H5$→_{10℃搅拌12h}^{浓H_{2}SO_{4}}$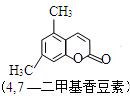

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的说法中正确的是( )
)的说法中正确的是( )| A. | 分子组成符合通式CnH2n+2 | |
| B. | 分子中含有3个C-C键和3个C=C键 | |
| C. | 在空气中燃烧时产生较多的黑烟 | |
| D. | 苯中加入溴水后溴水层颜色变浅,这是发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com