
【题目】常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是
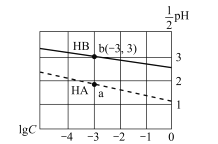
A. HB的电离常数(KA)数量级为10-3
B. 其钠盐的水解常数(Kh)大小关系是:NaB>NaA
C. a、b两点溶液中,水的电离程度b<a
D. 当lg C= -7时,两种酸溶液均有pH=7
科目:高中化学 来源: 题型:
【题目】硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为____________________________,其第一电离能比Be ____________(填“大”或“小”)
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______________。
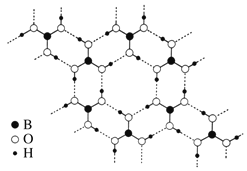
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。
①B原子的杂化方式为_____________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:________________________________________________________。
② 路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸的原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键
B. K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2-
C. 金属Zn中Zn原子堆积模型如图3所示,空间利用率为68%
D. 金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
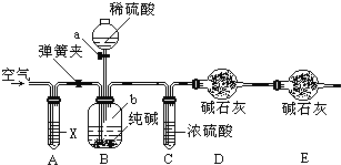
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为85.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为87.6g.试回答:
(1)鼓入空气的目的是___________,装置A中试剂X应选用___________;
(2)若没有C装置,则会导致测定结果___________(填“偏大”或“偏小”);
(3)装置B中发生反应的离子方程式______________________________;
(4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为_________(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
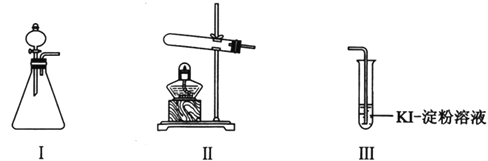
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,.向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)________________________造成的,请设计实验证明他们的猜想是否正确________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是
A. 此配合物中存在离子键、配位键、极性键、非极性键
B. 配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6,配位原子有C和N
C. 1mol配合物中σ键数目为12NA
D. 该配合物为离子化合物,易电离,1mol配合物电离共得到3NA阴阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水;草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是________________________,由此可知草酸晶体分解的产物中有_______。
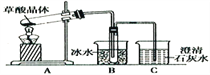
装置B的主要作用是_________________________________________________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置进行实验。

①乙组的实验装置中,依次连接的合理顺序为A→B→(_____)→( )→( )→( )→I。装置H反应管中盛有的物质是__________;I中集气瓶收集到的气体主要是_________。
②能证明草酸晶体分解产物中有CO的现象是_______________________________。
(3)丙组同学欲进一步证明产物CO能否与Na2O2反应。从A~J中选用装置进行实验,最简单的装置接口连接顺序是:A→B→(_____)→J(盛Na2O2的干燥管);实验后用J中的固体进行验证的方法是:__________________________________(可另选试剂)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN的摩尔质量为41 g
D. AlN中氮的化合价为+3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不符合第ⅦA族元素性质特征的是( )
A.易形成-1价离子B.从上到下原子半径逐渐减小
C.最高价氧化物的水化物显酸性D.从上到下氢化物的稳定性依次减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com