
| A. | 工业上用生石灰做脱硫剂 | B. | 氯化铁腐蚀铜刻制印刷电路板 | ||
| C. | 明矾可用做净水剂 | D. | 氢氟酸可用玻璃器皿存放 |
分析 A.SO2能与CaO反应生成亚硫酸钙,最终生成硫酸钙;
B.氯化铁与Cu反应生成氯化亚铁和氯化铜;
C.明矾在溶液中电离出铝离子能水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性;
D.氢氟酸能与玻璃中的成分反应.
解答 解:A.SO2能与CaO反应生成亚硫酸钙,最终生成硫酸钙,可防止二氧化硫的污染,所以工业上用生石灰做脱硫剂,故A正确;
B.氯化铁与Cu反应生成氯化亚铁和氯化铜,则氯化铁能腐蚀铜刻制印刷电路板,故B正确;
C.明矾在溶液中电离出铝离子能水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,能吸附水中的悬浮颗粒形成沉淀,从而起到净水作用,故C正确;
D.氢氟酸能与玻璃中的成分二氧化硅反应生成四氟化硅气体和水,所以不能用玻璃容器盛放氢氟酸,故D错误.
故选D.
点评 本题考查元素化合物性质以及应用,侧重于元素化合物知识的综合理解和运用的考查,有利于培养学生良好的科学素养,难度不大,注意把握相关物质的性质.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:实验题
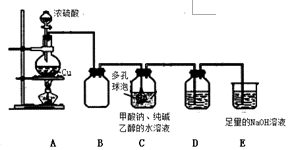 已知:①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O某小组进行如下实验:
已知:①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O某小组进行如下实验:| 假设 | 操作 | 现象 | 原理 |
| Na2S2O4 为强 碱弱酸盐,其溶 液为碱性. | 取少量溶液于试管中, 滴加紫色水蕊试液 | 溶液变 成蓝色 | S2O42-水解,使溶液成碱性 |
| Na2S2O4 中 S为+3 价,具有较强 的还原性. | 取少量溶液于试管中, 滴加过量新制氯水,再 滴加 BaCl2 溶 | 有白色沉淀生 成 | 该反应的离子方程式为:4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ ,Ba2++SO42-=BaSO4↓; |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
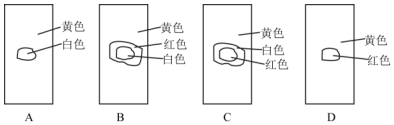
 、
、 、
、 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大多数合金的熔点比它的各成分金属的高 | |
| B. | 生铁和钢都是铁的合金,生铁的含碳量低于钢 | |
| C. | 日常生活中使用更多的是纯金属而不是合金 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液与Ba(OH)2溶液混合 | B. | NH4Cl溶液与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与KOH溶液混合 | D. | CH3COOH溶液与NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na→NaOH→Na2CO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Cu→CuCl2→Cu(OH)2→CuSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,乙中CO2的转化率大于60% | |
| B. | 平衡时,甲中和丙中H2的转化率均是60% | |
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol•L-1 | |
| D. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH和AlCl3 | B. | 稀盐酸和NaOH | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com