
己知在碱性溶液中可发生如下反应:
2R(OH)3 + 3C1O- + 4OH- = 2RO4n-+3Cl- +5H2O。则RO4n-中R的化合价是
A.+3 B.+4 C.+5 D.+6
科目:高中化学 来源:2016届四川省高三9月月考化学试卷(解析版) 题型:选择题
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是

①1mol该有机物可消耗3mol H2;
②不能发生银镜反应;
③分子式为C12H20O2;
④它的同分异构体中可能有酚类;
⑤1 mol该有机物水解时只能消耗1 mol NaOH
A.②③④ B.①④⑤ C.①②③ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中高二上期初考试化学试卷 (解析版) 题型:选择题
下列叙述是小明做完铜、锌原电池的实验后得出的结论和认识,你认为正确的是
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.电子沿外导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三9月月考化学试卷(解析版) 题型:填空题
(14分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)
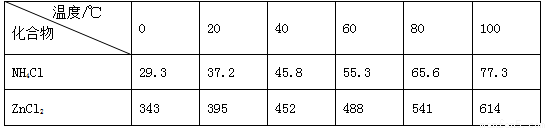
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的负极为 ,正极反应式为 ,
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn g(已知F=96500C/mol)。
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过 分离回收,滤渣的主要成分是二氧化锰、 和 ,欲从中得到较纯的二氧化锰,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为 加碱调节PH为 ,铁刚好完全沉淀(离子浓度≤1×10-5mo1·L-1时即可认为离子沉淀完全)继续加碱调节PH为 锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1 mo1·L-1)。若上述过程不加双氧水的后果 ,原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届山西省忻州市高三上学期第一次月考化学试卷(解析版) 题型:实验题
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂。其生产流程如下:
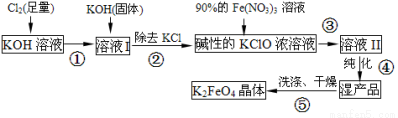

(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KclO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为 mol。从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图2所示。电解过程中阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期开学考试化学试卷(解析版) 题型:推断题
(10分)下图中A~J均为有机化合物。
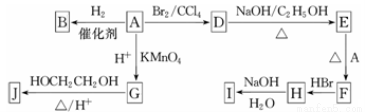
根据图中信息,回答下列问题:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.20%。B的一氯代物仅有一种,B的结构简式为 。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为 。
(3)由A生成D的反应类型是 。
(4)G的分子式为C6H10O4,0.146 g G需用20 mL 0.100 mol·L-1 NaOH溶液完全中和,J是一种高分子化合物。则由G转化为J的化学方程式为 。
(5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应:
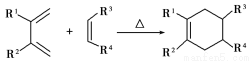 ,
,
则由E和A反应生成F的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期开学考试化学试卷(解析版) 题型:选择题
验证某有机物属于烃,应完成的实验内容是
A.只需测定它的C、H原子数目比
B.只需证明它完全燃烧后产物只有H2O和CO2
C.只需测定其燃烧产物中H2O和CO2物质的量的比值
D.测定该试样的质量及试样完全燃烧后生成H2O和CO2的质量
查看答案和解析>>
科目:高中化学 来源:2016届广西河池市高三上学期第一次月考理综化学试卷(解析版) 题型:选择题
下列描述与所得结论正确的是
选项 | 描述 | 结论 |
A | 化合物A在熔融状态下可以导电 | A为离子化合物 |
B | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,无K+ |
C | 将a、c两种金属相连后投到稀硫酸溶液中,a表面产生气泡 | 金属性a>c |
D | NH4NO3溶液和稀HNO3溶液都可以使石蕊变红 | 它们均能电离出H+ |
查看答案和解析>>
科目:高中化学 来源:2016届山东省滕州市高三第一学期开学初检测化学试卷(解析版) 题型:填空题
〔化学——选修3:物质结构与性质〕举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼 (N2H4和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为 ,第一电离能最大的元素为 。
(2)钛的原子序数为22,其基态电子排布式示意图为 。
(3)1 mol N2H4分子中含有的键数目为 。
(4)H2O2分子结构如图1,其中心原子杂化轨道为 ,估计它难溶于CS2,简要说明原因 。
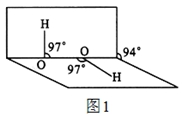
(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为 ,若立方氮化硼的密度为g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。
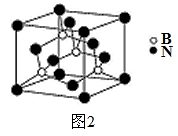
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com