
����Ŀ����ҵ�ϳ��÷�¯��(��Ҫ��FeO��V2O5����������SiO2��P2O5������)��ȡV2O5���������£�

��1�����յ�Ŀ���ǽ�FeO��V2O3ת��Ϊ������NaVO3���ù����б�������Ԫ����_______________������������Ҫ�ɷ�Ϊ____________________(�ѧʽ)��
��2����MgSO4��Һ���衢��ʱ����������Ҫ�ɷ�Ϊ__________��
��3���ڱ���NH4VO3�Ĺ����У����������ļ���ֵ(������)���¶ȱ仯��������ͼ��ʾ��210��ʱ��ʣ��������ʵĻ�ѧʽΪ_____________________��

��4����V2O5ұ���������������ȷ����������ȷ�Ӧ��ʵ�������__________________.
��5����V2O5��������ϡ����õ�250mL(VO2)2SO4��Һ��ȡ25.00mL����Һ����ƿ�У���0.1000 mol��L-1H2C2O4����Һ���еζ����ﵽ�ζ��յ�ʱ���ı���Һ�����Ϊ20.00mL����֪�ζ�������H2C2O4������ΪCO2��VO2+(��ɫ)����ԭΪVO2+(��ɫ)��
�ٸõζ�ʵ�鲻��Ҫ�������ָʾ�����ﵽ�ζ��յ��������___________________��
��(VO2)2SO4��Һ�����ʵ����ʵ���Ũ��Ϊ___________________��
�۴ﵽ�ζ��յ�ʱ�����ӵζ��ܶ�����ʹ���_________(�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��
���𰸡� Fe��V Fe2O3 MgSiO3��Mg3(PO4)2 HVO3 �����ȼ��Ϸ���һ��KClO3������þ������ȼ ��Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ� 0.080mol��L��1 ƫ��
����������¯������Ҫ��FeOV2O3����������SiO2��P2O5�����ʣ�������̼����ͨ��������գ�����ˮ�����˵õ�������Ҫ������������Һ�м�������þ��ȥ�����������ˣ���������Ҫ�ɷ�ΪMgSiO3��Mg3(PO4)2����Һ�м�������麟�������NH4VO3�����ȷֽ�����V2O5����
��1�����յ�Ŀ���ǽ�FeOV2O3ת��Ϊ������NaVO3���������Ͷ�����̼����Ӧ��Fe��VԪ�صĻ��ϼ����ߣ���˸ù����б�������Ԫ����Fe��V����ת��Ϊ�����������Խ���������Ҫ�ɷ�ΪFe2O3����2���������Ϸ�����֪��MgSO4��Һ���衢��ʱ��������Ҫ�ɷ�ΪMgSiO3��Mg3(PO4)2����3��NH4VO3�ֽ�Ĺ��������ɰ�����HVO3��HVO3��һ���ֽ�����V2O5��210��ʱ���ֽ�������Ͱ�������ʣ�����ռ��ʼ����ٷֺ���Ϊ100/117��100%=85.47%������210��ʱ��ʣ��������ʵĻ�ѧʽΪ��HVO3����4���������ȷ�Ӧ��ʵ������������ȼ��Ϸ���һ��KClO3������þ������ȼ����5������֪�ζ�������H2C2O4������ΪCO2��VO2+(��ɫ)����ԭΪVO2+(��ɫ)�����Ըõζ�ʵ�鲻��Ҫ�������ָʾ�����ﵽ�ζ��յ����������Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ����ڷ�Ӧ��VԪ�ػ��ϼ۴�+5�۽��͵�+4�ۣ��õ�1�����ӣ�̼Ԫ�ػ��ϼ۴�+3�����ߵ�+4�ۣ�ʧȥ1�����ӣ�����ݵ��ӵ�ʧ�غ��֪�μӷ�Ӧ��(VO2)2SO4�����ʵ������ڲ�������ʵ�������Ϊ0.1mol/L��0.02L����(VO2)2SO4��Һ�����ʵ����ʵ���Ũ��Ϊ![]() ���۴ﵽ�ζ��յ�ʱ�����ӵζ��ܶ����������ƫС�����ı�Һ������٣���˽�ʹ���ƫ�͡�
���۴ﵽ�ζ��յ�ʱ�����ӵζ��ܶ����������ƫС�����ı�Һ������٣���˽�ʹ���ƫ�͡�


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ͬŨ�ȵ�NaOH��Һ���ֱ�ζ�Ũ�Ⱦ�Ϊ0.1mol��L��1��������(HA��HB��HD)��Һ���ζ���������ͼ��ʾ�������жϴ������( )
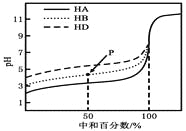
A. ������ĵ��볣����ϵ��KHA��KHB��KHD
B. �ζ���P��ʱ����Һ�У�c(B��)��c(Na��)��c(HB)��c(H��)��c(OH��)
C. pH=7ʱ��������Һ�У�c(A��)=c(B��)=c(D��)
D. ���кͰٷ�����100%ʱ����������Һ��Ϻ�c(HA)��c(HB)��c(HD)=c(OH��)��c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ�����塢��Һ���ַ�ɢϵ�ı��������ǣ� ��
A. ��ɢ������ֱ����С B. �Ƿ��ж����ЧӦ
C. �Ƿ��һ���ȶ����� D. �Ƿ�������ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ư�����õ������У��� ���� �� �������� �� ����̿ �� �������� ��Ư��ԭ����ͬ����
A. �٢� B. �ڢ� C. �٢� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ������֮Դ���������ǵ�����������ء�
��1������ˮ�����ø������(K2FeO4)����ˮ�ʡ����������������ɱ������ͬʱ����ˮ���õ�ԭ��_____________________________________________________________��
��2����Ʒ�ˮ�к��о綾��NaCN������NaClO�����ü��Է�ˮʱ����Na2CO3��NaCl��N2��
��д���÷�Ӧ�����ӷ���ʽ��__________________________________________��
�ڴ���a m3��NaCN bmg��L-1�ķ�ˮ��������ҪNaC1O������Ϊ______________g��
��3��ij��ҵ��ˮ�п��ܺ���Na+��Mg2+��A13+��Fe3+��NH4+��CO32-��SO42-��NO3-�еļ��֣�Ϊȷ����ɷ֣��������ʵ�飺
a��ȡ�÷�ˮ������ɫ��Ӧʵ�飬����Ϊ��ɫ��
b����ȡ10mL�÷�ˮ���Թ��У�����������Ba(NO3)2��Һ��ϡ���ᣬ��ַ�Ӧ����˵õ�4.66g��ɫ������
c����ȡ10mL�÷�ˮ���Թ��У��μ�NaOH��Һ����������������������NaOH��Һ����ı仯��ϵ����ͼ��ʾ(�����dz������ܽ����ʧ)��

��������ʵ���ͼ�����ݻش�
�ٸù�ҵ��ˮ��һ�������ڵ�������_________________(д���ӷ���)��
��c(NaOH)=_____________________��
��NO3-�Ƿ����?_______(����ڡ����������ڡ���ȷ����)��������_____________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F����ѧ��ѧ�г��������ֶ�����Ԫ�أ��й�λ�ü���Ϣ���£�A������������Ӧ��ˮ���������⻯�ﷴӦ�������ӻ����C����һ�㱣����ú���У�F������������Ӧ��ˮ���������ǿ�ᷴӦ������ǿ�Ӧ��G�������ճ��������������Ľ������ױ���ʴ������ش��������⣺
��1��AԪ�ص��⻯��ˮ��Һ��ʹ��̪����ԭ���õ��뷽��ʽ����Ϊ_____________��
��2��ͬ��ͬѹ�£���a L A�⻯��������b L D���⻯�������Ⱥ�ͨ��һʢˮ���ձ��У���������Һ��pH=7����a_________b(����>"����<������=��)��
��3�������£���ͬŨ��F��G�����ӵ���Һ�еμ�NaOH��Һ��F��G��Ԫ���Ⱥ������F(OH)n��ȫ������pH��4.7��G(OH)n��ȫ������pH��2.8��������ͬ�����£��ܽ�Ƚϴ���ǣ�___���ѧʽ����
��4��A��B�����������Ϊ7:16����ԭ�ӷ��ӣ��÷����ͷ��ڿ������仯ѧ���ÿ��������ĺ���У�_______________��
������ ������ЧӦ �۹⻯ѧ���� �ܳ������ƻ�
��5��A��C��ɵ�һ�����ӻ��������ˮ��Ӧ�������ּ�÷�Ӧ�Ļ�ѧ����ʽ��______��
��6���õ���ʽ��ʾB,C�γɻ�����C2B2�Ĺ���_______________��
��7����֪һ������E��������B2(g)��ȼ�գ�����ܵIJ��P������ϵ����ͼ��ʾ����д��һ��������EB2(g) ��E(s)��Ӧ����EB(g)���Ȼ�ѧ����ʽ__________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯��������������������������Ҫ�����á�һ���ɺ�������������ʾ��ͼ���£�

��1���ٷ�Ӧ2�Ļ�ѧ����ʽΪ___________���÷�Ӧ����ת������Ҫ��ʽΪ_________��
�ڷ�Ӧ4���Ȼ�ѧ����ʽΪ2H2SO4(l)![]() 2SO2(g)+O2(g)+2H2O(g) ��H��+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) ��H��+550kJ/mol
��֪��a. H2SO4(l)![]() SO3(g)+H2O(g) ��H=X
SO3(g)+H2O(g) ��H=X
b.2SO3(g)![]() 2SO2(g)+O2(g) ��H=+196kJ/mol
2SO2(g)+O2(g) ��H=+196kJ/mol
��X=____________��
��2��SO2��һ�ִ�����Ⱦ������֪�� 2SO2(g)+O2(g)![]() 2SO3(g) ��H<0��
2SO3(g) ��H<0��
�������йظ÷�Ӧ���ʵ�������ȷ����_____________������ĸ����
a�������¶ȿ����������Ӱٷ������ӿ췴Ӧ����
b������ѹǿ���������Ӱٷ������ӿ췴Ӧ����
c��ʹ�ô�������ʹ��Ӧ�����ƽ���������ߣ��ӿ췴Ӧ����
d��������һ��������£����������ı������С���Է�Ӧ����������Ӱ��
�ڸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=____________��
�������й�ͼ��һ����ȷ����__________������ĸ����

��3�����мס������������ȵĺ����������������г���1molSO2��1molO2���������г���1molSO3��0.5molO2��������Ӧ��2SO2(g)+O2(g)![]() 2SO3(g) ��H<0���ס���������ʼ��Ӧ�¶���ͬ����������Ϊ����������ƽ��ʱ����������SO2��ת����Ϊa����������SO3�ķֽ���Ϊb����
2SO3(g) ��H<0���ס���������ʼ��Ӧ�¶���ͬ����������Ϊ����������ƽ��ʱ����������SO2��ת����Ϊa����������SO3�ķֽ���Ϊb����
��a+b__________1������<������>������=������
������������˵���������з�Ӧ��ƽ��״̬����_______________������ĸ����
A.v��(O2)=2v��(SO3) B.���������ܶȲ���
C.c(SO2)=c(SO3) D.�������������ʵ�������
E.�������¶Ȳ��� F.SO2��O2�������Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA ��ʾ�����ӵ�������ֵ������˵����ȷ����
A. T ��ʱ��1 L pH=6�Ĵ�ˮ�У���10��8NA��![]()
B. 15.6 g Na2O2�����CO2��Ӧʱ��ת�Ƶĵ�����Ϊ0.4NA
C. 1 mol SiO2���30 mol ����
D. 14 g����ʽΪCnH2n��(n��2)�����к��е�C=C����Ŀһ��ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ400mL 0.5molL��1��ϡ������Һ�������ܶ�Ϊ1.84gmL��1 �� ��������Ϊ98%Ũ���������ƣ���ش��������⣺
��1����Ҫʵʩ���ƣ����������У������õ�����������ĸ����
A.250mL����ƿ��
B.500mL����ƿ��
C.������ƽ��
D.��Ͳ��
E.�ձ���
F.������
��2�����ƹ����У������������⣬��ȱ�������� ��
��3��δ��ȴ����������ת��������Һ��������������Һ��Ũ�����ƫ�ߡ�����ƫ�͡�����Ӱ�족����ͬ����������ʱ���μ�����ˮ���������˿̶��ߣ�������������Һ��Ũ�� ��
��4��ͨ�����㣬����Ͳ��ȡmLŨ���ᣮ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com