
(12分)
(1)现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
① 酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
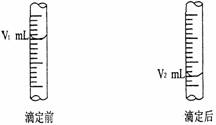 ② 右图是酸式滴定管中液面在滴定前后的读数:
② 右图是酸式滴定管中液面在滴定前后的读数:
试用有关符号表示该待测NaOH溶液的物质的量
浓度:c (NaOH) = _________________ mol/L。
③ 若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏_________________。
(2) 已知空气中含有N2、O2、CO2、H2S等气体。试判断下列滴定操作的终点、分析出现下列现象的原因。(或用有关离子方程式表示)
① 以酚酞为指示剂,用碱液滴定酸液到 为终点。约半分钟后导致褪色的原因: 。
② 以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32—+I2 = S4O62—+2I—)到 为终点,约5min后溶液又显色的原因: 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| a(V2-V1) |
| V |
| a(V2-V1) |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现用物质的量浓度为amol/L的标准盐酸去测定VmLNaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
②下图是酸式滴定管中液面在滴定前后的读数,则被测NaOH溶液的的物质的量浓度为:c(NaOH)= ________________。
③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测得的NaOH溶液的物质的量浓度会偏_________________。
(2)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。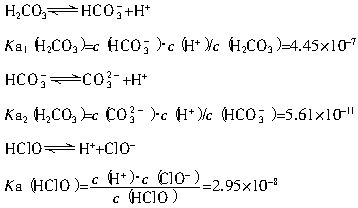
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将过量的氯气通入到少量的碳酸钠溶液中______________________________________;
②氯气和碳酸钠按照1∶1的比例恰好反应_____________________________________。
(3)铬是1979年法国化学家沃克兰在分析铬铅矿时首先发现的。铬位于周期表中第四周期ⅥB族,其主要化合价为+6、+3、+2,其中+3较为稳定。某兴趣小组对铬的化合物进行探究性研究发现:Cr2O3微溶于水,与A12O3类似,是两性氧化物;Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡。Cr(OH)3酸式电离的电离方程式是:_________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省嘉峪关一中高二(上)期中化学试卷(理科)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com