解:(1)实验室配制100mL 0.100mol?L
-1 Na
2CO
3溶液需要Na
2CO
3的物质的量为:0.1L×0.1mol/L=0.01mol,Na
2CO
3?10H
2O的物质的量为0.01mol,Na
2CO
3?10H
2O的质量为:0.01mol×286g/mol=2.86g,但天平的精确度为0.1g,所以需要称量晶体为2.9g;若所取的晶体已经有一部分失去了结晶水,溶质碳酸钠的质量偏大,即n偏大,根据c=

分析可知溶液的浓度偏大,
答案为:2.9;大;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管、玻璃棒;
(3)加水至液面距离刻度线1~2cm时,用胶头滴管向容量瓶中滴加溶液,该操作的名称是定容;
如果俯视刻度线,溶液的体积偏小,根据c=

分析可知配制的浓度将偏大;
转移后,用蒸馏水洗涤玻璃棒的操作名称是洗涤;
若没有洗涤,溶质的物质的量偏小,根据c=

分析可知配制的浓度将偏小;
故答案为:定容;大;洗涤;小;
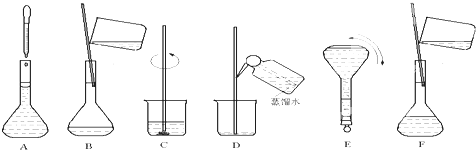
(4)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,所以实验过程先后次序排列为:C、B、D、F、A、E,
故答案为:C、B、D、F、A、E;
分析:(1)根据n=cv计算溶质Na
2CO
3的物质的量,利用Na
2CO
3?10H
2O的物质的量等于Na
2CO
3的物质的量,根据m=nM计算Na
2CO
3?10H
2O的质量;根据c=

分析操作对溶质的物质的量或对溶液的体积的影响判断;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(3)用胶头滴管滴加溶液的操作名称是定容;用蒸馏水洗涤玻璃棒的操作名称是洗涤;根据c=

分析操作对溶质的物质的量或对溶液的体积的影响判断;
(4)根据配制溶液的实验操作过程进行实验步骤排序.
点评:本题考查一定物质的量浓度溶液的配制,难度不大,注意实验步骤、误差分析为易错点.


 分析可知溶液的浓度偏大,
分析可知溶液的浓度偏大, 分析可知配制的浓度将偏大;
分析可知配制的浓度将偏大; 分析可知配制的浓度将偏小;
分析可知配制的浓度将偏小; 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断; 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;