
分析 ①根据V=$\frac{m}{ρ}$计算溶液体积;
②根据c=$\frac{n}{V}$计算;
③根据稀释定律:稀释前后溶质的质量(物质的量)不会发生变化列式计算.
解答 解:①在57.5g水中溶解2.5gCuSO4•5H2O,则溶液的质量=17.5g+2.5g=20g,该溶液的体积V=$\frac{20g}{1.2g/c{m}^{3}}$=$\frac{50}{3}$cm3≈16.7cm3,答:该溶液的体积是16.7cm3;
②2.5gCuSO4•5H2O中硫酸铜物质的质量是2.5g×$\frac{160}{250}$×100%=1.6g,物质的量是$\frac{1.6g}{160g/mol}$=0.01mol,该溶液中CuSO4的物质的量浓度=$\frac{0.01mol}{\frac{50}{3}×1{0}^{-3}L}$=0.6mol/L,
答:溶液中CuSO4的物质的量浓度是0.6mol/L;
③取出20.0ml该溶液,配成浓度为0.10mol/L的稀溶液,设稀释后溶液的体积是VmL,则20.0mL×0.6mol/L=VmL×0.1mol/L,解得V=120mL,答:稀释后溶液的体积是120mL.
点评 本题考查物质的量浓度有关计算、物质的量有关计算,难度不大,注意对公式的理解与灵活应用.


科目:高中化学 来源: 题型:选择题
| A. | 用石墨电极电解加有酚酞的饱和食盐水,由于氢氧根离子向阳极移动,所以阳极区溶液首先变为红色 | |
| B. | 在铁管上镀锌时,铁管与直流电源的正极相接 | |
| C. | 给蓄电池充电时,直流电源的正极与蓄电池的正极相接,发生氧化反应 | |
| D. | 粗铜中含有少量锌、银等金属,电解精炼该粗铜时,阳极只发生的反应是:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
| pH | 8.4 | .6 | 7.5 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑤ | C. | ③⑤⑥ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
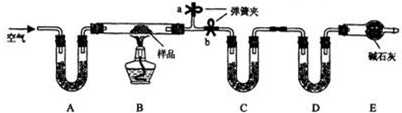
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
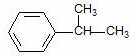 .
.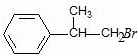 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com