
| A. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
分析 A、依据PH计算氢离子浓度,结合溶液中离子积常数计算碱溶液中氢氧根离子浓度,水溶液中水电离也生成氢氧根离子分析判断;
B、氯气与氢氧化钠溶液飞反应中,氯气既是氧化剂也是还原剂,属于歧化反应;
C、根据乙烯和丁烯的最简式都是CH2的特点来分析;
D、标况下,甲醇为液态.
解答 解:A、25℃时,pH=13的1.0L Ba(OH)2溶液中,碱含有的OH-数目为0.2NA,水存在电离生成氢氧根离子,所以溶液中氢氧根离子大于0.2NA,故A错误;
B、标况下2.24L氯气的物质的量为0.1mol,氯气与氢氧化钠的反应是歧化反应,因此0.1mol氯气与氢氧化钠溶液反应转移了0.1mol电子,转移的电子总数为0.1NA,故B错误;
C、乙烯和丁烯的最简式都是CH2,则$\frac{21g}{14g/mol}$,所以n(C)=1.5mol,N(C)=1.5NA,故C正确;
D、标况下,甲醇为液态,故不能根据气体摩尔体积来计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③正确 | B. | ①②⑤正确 | C. | 都正确 | D. | ②③④⑤正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,SO2不能完全转化为SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
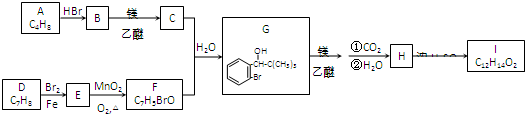
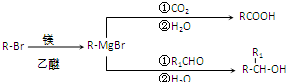
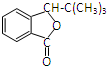 .
. .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓度都为0.1mol•L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应 | |
| C. | 向浓度都为0.1mol•L-1的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应 | |
| D. | 向0.1mol•L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解 | |
| B. | Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Cu、Fe、Al | |
| D. | 反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,FeS2中的硫元素全部被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
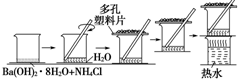 研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:
研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com