把6.5g 锌粉放入足量的盐酸中,锌完全反应.试计算:
(1)6.5g锌的物质的量______;
(2)参加反应的氯化氢的物质的量______;
(3)生成氢气的体积(标准状况)______.
【答案】
分析:(1)根据n=
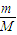
计算6.5g锌的物质的量;
(2)根据Zn+2HCl=ZnCl
2+H
2↑计算参加反应的氯化氢的物质的量;
(3)根据Zn+2HCl=ZnCl
2+H
2↑计算生成氢气的物质的量,再根据V=nV
m计算.
解答:解:(1)6.5g锌的物质的量为
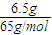
=0.1mol,
故答案为:0.1mol;
(2)令参加反应的HCl为xmol,则:
Zn+2HCl=ZnCl
2+H
2↑
1 2
0.1mol x
故x=0.2mol,
故答案为:0.2mol;
(3)令生成的氢气物质的量为ymol,则:
Zn+2HCl=ZnCl
2+H
2↑
1 1
0.1mol y
故y=0.1mol,
所以生成氢气的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L.
点评:本题考查根据方程式的有关计算,比较基础,旨在考查学生对基础知识的掌握.

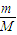 计算6.5g锌的物质的量;
计算6.5g锌的物质的量;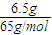 =0.1mol,
=0.1mol,
