
有机物的种类繁多,但其命名中是有规则的。下列有机物命名正确的是
A.CH3(CH2)4CH3 1,4二甲基丁烷
B.CH3CH(CH3)CH=CH2 甲基丁烯
C.CH3CH2CH(CH3) CH2OH 2甲基1丁醇
D.CH2ClCH2Cl 二氯乙烷
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:2014-2015四川省邛崃市高二下学期第一次月考化学试卷(解析版) 题型:填空题
Ⅰ、(1)已知下列两个热化学方程式:
H2(g)+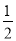 O2(g)===H2O(l) ΔH=-285.0 kJ/mol
O2(g)===H2O(l) ΔH=-285.0 kJ/mol
C3H8(g)+5O2(g)===4H2O(l)+3CO2(g) ΔH=-2220.0 kJ/mol
①已知:H2O(l)===H2O(g) ΔH=+44.0 kJ· mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式:
_________________________________________。
②实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热6262.5 kJ,则混合气体中H2和C3H8的体积比是______________。
(2)已知:P4(白磷,s)+5O2(g)===P4O10(s) ΔH=-2983.2 kJ/mol
P(红磷,s)+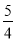 O2(g)===
O2(g)===  P4O10(s) ΔH=-738.5 kJ/mol
P4O10(s) ΔH=-738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式____________________________________
相同状况下,能量较低的是________;白磷的稳定性比红磷 (填“高”或“低”)。
Ⅱ、(3分)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二4月月考化学试卷(解析版) 题型:选择题
某烃的分子式为C11H20,1mol该烃在催化剂作用下可以吸收2molH2;用酸性KMnO4溶液氧化,得到丁酮(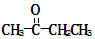 )、丙酮(
)、丙酮(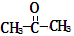 )和琥珀酸(
)和琥珀酸(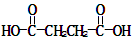 )三者的混合物。该烃的结构简式为
)三者的混合物。该烃的结构简式为
A.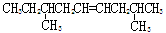
B.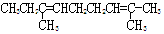
C.
D.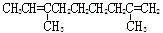
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省宜春市高二下学期第一次月考化学试卷(解析版) 题型:填空题
有机化合物A、B分子式不同,它们只可能含碳、氢、氧元素中的两种或三种.如果将A、B不论以何种比例混和,只要其物质的量之和不变,完全燃烧时所消耗的氧气和生成的水的物质的量也不变.那么,A、B组成必须满足的条件是 ; .若A是甲烷,则符合上述条件的化合物B中,分子量最小的是(写出分子式) ,并写出分子量最小的含有甲基的B的2种同分异构体结构简式: , 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省宜春市高二下学期第一次月考化学试卷(解析版) 题型:选择题
化学式为C5H12O2的二元醇有多种同分异构体。其中主链上有3个碳原子和主链上有4个碳原子的二元醇,其同分异构体数目分别是(不包括1个碳原子上连接2个羟基的化合物):
A.1和6 B.1和7 C.2和6 D.2和7
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省宜春市高二下学期第一次月考化学试卷(解析版) 题型:选择题
为把溴水中溴单质萃取出来,下列物质可达到目的的是
A.乙醇 B.苯酚溶液 C.直馏汽油 D.乙酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市东城区高三综合能力测试二理综化学试卷(解析版) 题型:实验题
(15分)实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ.用pH试纸检验,漂白液pH>7,饱和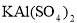 溶液pH<7。
溶液pH<7。
Ⅱ.取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ.另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ.再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出反应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用下图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。
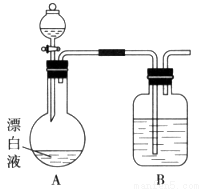
①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式__________。
③若打开分液漏斗活塞向烧瓶中加入饱和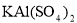 溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生。A中加
溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生。A中加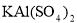 溶液反应的离子方程式是__________。
溶液反应的离子方程式是__________。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省台州市高二下学期第一次月考化学试卷(解析版) 题型:填空题
(6分)(1)1mol某烃A与1mol H2起反应生成1mol乙苯,该加成反应的化学方程式为:
_________________________________________________________;
烃A发生加聚反应的化学方程式为____________________________________;
(2)写出60℃时1,3—丁二烯与溴1:1反应的方程式_________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
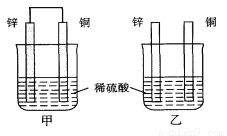
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com