
| m |
| M |
| m |
| M |
| m |
| M |
| M |
| Vm |
| m |
| M |
| m |
| M |
| m |
| M |
| M |
| Vm |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
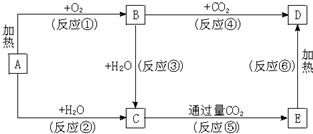
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
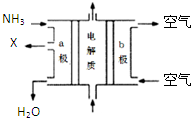 工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.
工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.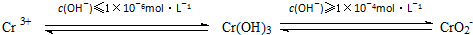
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、着色剂_______苯甲酸钠 |
| B、调味剂_______食盐 |
| C、营养强化剂_______亚硝酸钠 |
| D、防腐剂_______苋菜红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com