氢能以其洁净、高效、高热值、环境友好等特点成为最有前途的新能源,制氢和储氢方法很多.
(1)直接热分解法制氢
| 序号 |
分解水的过程 |
平衡常数 |
T=2500K |
T=3000K |
| A |
H2O(g)?HO(g)+H(g) |
K1 |
1.34×10-4 |
8.56×10-3 |
| B |
HO(g)?H(g)+O(g) |
K2 |
4.22×10-4 |
1.57×10-2 |
| C |
2H(g)?H2(g) |
K3 |
1.52×103 |
3.79×10 |
| D |
2O(g)?O2(g) |
K4 |
4.72×103 |
7.68×10 |
①属于吸热反应的是:
(选填:A、B、C、D)
②某温度下,H
2O(g)?H
2(g)+
O
2(g),平衡常数K=
(用含K
1、K
2、K
3、K
4表达)
(2)热化学循环制氢
已知:Br
2(g)+CaO(s)→CaBr
2(s)+
O
2(g)△H=-73kJ/mol
3FeBr
2(s)+4H
2O(g)→Fe
3O
4(s)+6HBr(g)+H
2(g)△H=384kJ/mol
CaBr
2(s)+H
2O(g)→CaO(s)+2HBr(g)△H=212kJ/mol
Fe
3O
4(s)+8HBr(g)→Br
2(g)+3FeBr
2(s)+4H
2O(g)△H=-274kJ/mol
则H
2O(g)?H
2(g)+
O
2(g),△H=
KJ/mol
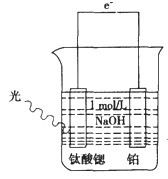
(3)光电化学分解制氢,其原理如图1.
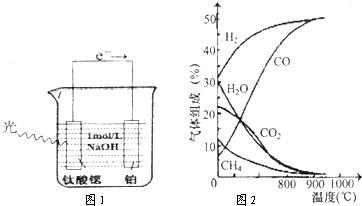
钛酸锶光电极的电极反应为4OH
一+4hv-O
2+2H
2O,则铂电极的电极反应为
.
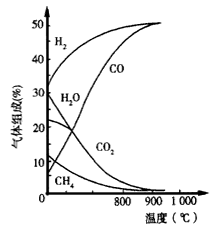
(4)生物质制氢,若将生物质气化炉中出来的气体[主要有CH
4、CO
2、H
2O(g)、CO及H
2]在1.0 1×10
5Pa下,进入转换炉,改变温度条件,各成分的体积组成关系如图2所示.下列有关图象的解读正确的是
.
A.利用CH
4与H
2O(g)及CO
2转化为合成气CO和H
2理论上是可行的
B.CH
4(g)+CO
2(g)→2CO(g)+2H
2(g)和CH
4(g)+H
2O(g)→CO(g)+3H
2(g),都是放热反应
C.CH
4与CO
2及H
2O(g)转化为合成气CO和H
2适宜温度约900℃
D.图象中曲线的交点处表示反应达到平衡
(5)LiBH
4由于具有非常高的储氢能力,分解时生成氢化锂和两种单质,试写出反应的化学方程式
.




 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案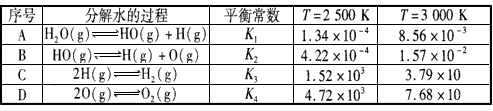
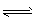 H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。
H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。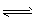 H2 (g) +1/2O2 ( g) △H=-___kJ/mol。
H2 (g) +1/2O2 ( g) △H=-___kJ/mol。