
分析 NaH2PO2为正盐,可将溶液中的Ag+还原为Ag,Ag元素的化合价降低,P元素的化合价升高,结合氧化剂与还原剂的物质的量之比为4:1及电子守恒计算.
解答 解:NaH2PO2为正盐,可将溶液中的Ag+还原为Ag,Ag元素的化合价降低,P元素的化合价升高,
设氧化产物中P元素的化合价为x,
由氧化剂与还原剂的物质的量之比为4:1及电子守恒可知:
4×(1-0)=1×(x-1),
解得:x=+5,
发生反应为:H3PO2+4Ag++2H2O=H3PO4+4Ag+4H+、H2PO2-+4Ag++2H2O=H3PO4+4Ag+3H+,
则NaH2PO2对应的氧化产物为H3PO4,
故答案为:H3PO4.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al>Mg>Na | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 熔点:纯铁>铝>铝合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,有关该化合物的叙述正确的是( )
,有关该化合物的叙述正确的是( )| A. | 该有机物属于芳香烃 | |
| B. | 该有机物不易溶于水 | |
| C. | 该有机物的原子一定处于同一平面 | |
| D. | 该有机物只能发生加成反应和酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | NaHCO3溶液中:c(OH-)+c(H2CO3)=c(H+)+c(CO32-) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;
;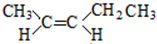 和
和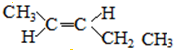 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com