
| �ɷ� | Na�� | K�� | Ca2�� | Mg2�� | Cl�� | SO42- | HCO3- |
| ����/mg��L��1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |





| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����XΪп����YΪNaCl��Һ������K����M�����ɼ������ĸ�ʴ�����ַ�����Ϊ�������������� |
| B����XΪ̼����YΪNaCl��Һ������K����N�����ɼ������ĸ�ʴ����Һ�е������������缫�ƶ� |
| C����XΪͭ����YΪ����ͭ��Һ������K����M����ͭ�����������ӣ���ʱ���·�еĵ�����ͭ�缫�ƶ� |
| D����XΪͭ����YΪ����ͭ��Һ������K����N�����������������ӣ���Һ��ͭ����Ũ�Ƚ���С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CH3OH��g����O2��g����2e��=H2O��l����CO2��g����2H����aq�� |
| B��O2��g����4H����aq����4e��=2H2O��l�� |
| C��CH3OH��g����H2O��l����6e��=CO2��g����6H����aq�� |
| D��O2��g����2H2O��l����4e��=4OH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
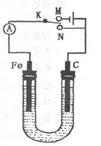
| A�����K��N���ӣ����������������ܸ�ʴ |
| B�����K��N���ӣ�������ӦʽΪ��4OH��-4e-=2H2O +O2 �� |
| C�����K��M���ӣ���ʯī������ͭ�����Ϳ�ʵ���������϶�ͭ |
| D�����K��M���ӣ���������������״��������33.6Lʱ������������lmol NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���״� | B����Ȼ�� | C��Һ��ʯ���� | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A������Ƭ�е�̼��ԭ��صĸ���,������ԭ��Ӧ |
| B����ˮ���Խ�ǿ,����Ƭʼ�շ������ⸯʴ |
| C��īˮҺ�����ʱ,������ӦʽΪ:O2+2H2O+4e-=4OH- |
| D��U�ι�����ҺpH��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

| A����·��ת��0.25 mol���� |
| B��Ǧ����������0.5 mol H2SO4 |
| C��Ǧ���صĸ�����ӦʽΪ��PbSO4��2H2O��2e��=PbO2��4H����SO |
| D��Fe�缫�����ĵ缫��ӦΪFe��2e��=Fe2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ڲ�H+���������ƶ� |
| B����һ���ĵ缫��ӦʽΪ��O2 + 4e�� + 2H2O = 4OH�� |
| C���Ҵ�������������Ӧ�����Ӿ������·���� |
| D������ܷ�ӦΪ��2CH3CH2OH+O2��2CH3CHO+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
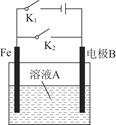
| ѡ�� | ����״̬ | ��ҺA | �缫B | ˵�� |
| A | ��K1���պ�K2 | NaCl | ʯī | ������Ӧ��O2��2H2O��4e��=4OH�� |
| B | ��K1���պ�K2 | NaCl | Zn | ����Ʒ�������������������������� |
| C | ��K2���պ�K1 | CuSO4 | Cu | �������ͭ |
| D | ��K2���պ�K1 | CuSO4 | ��ͭ | ��ⷨ����ͭ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com