
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度 | 10℃ | 30℃ | 40℃ | 50℃ | 60℃ |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |



科目:高中化学 来源: 题型:阅读理解
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
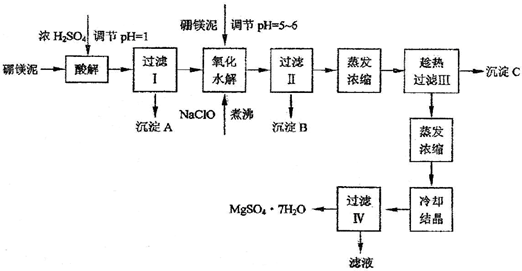
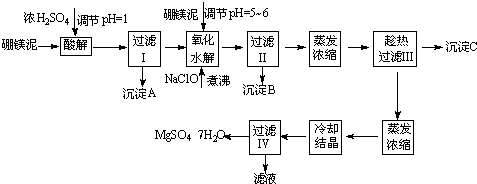
(12分)七水硫酸镁(MgSO4?7H2O)为白色细小四角柱状结晶,无臭,味苦,在干燥空气中易风化,易溶于水,缓溶于甘油,微溶于乙醇,热至68℃以上熔化。在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣――硼镁泥可制取七水硫酸镁。
表1 硼镁泥的主要化学成分
成分 | MgO | SiO2 | Fe2O3 | CaO | B2O3 | Al2O3 | MnO | CO2 |
质量分数% | 25-38 | 18-25 | 6-15 | 1-3 | 1-2 | 1-2 | 1-2 | 15-20 |
表2 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
硼镁泥制取七水硫酸镁的工艺流程如下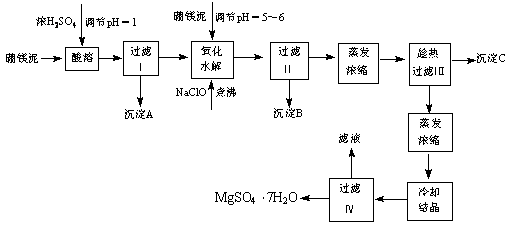
根据以上流程图并参考表格数据,试回答下列问题:
⑴ 硼镁泥是硼镁矿生产硼砂(Na2B4O7?10H2O)时的废渣。将硼镁矿(2MgO?B2O)锻烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应, 试写出反应方程式: 。
⑵ 沉淀A中除二氧化硅外,还含有硼酸,硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式 。
⑶ CaSO4的溶解度随温度升高变化不明显,在得到沉淀C时,对蒸发浓缩后的溶液却要进行趁热过滤,原因是 。
⑷ 经对沉淀B进行分析,发现其中含有二氧化锰,用方程式解释原因: 。
⑸ 用正三辛胺(TOA)做萃取剂,磺化煤油做稀释剂,通过有机萃取也可以用来除去硫酸镁浸出液中的铁。其主要反应如下:
Fe2++H2O=Fe(OH)2++H+ ⑴
Fe(OH)2++SO42-=Fe(OH)SO4 ⑵
2R3N+H2SO4=(R3NH)2SO4 ⑶
Fe(OH)SO4+(R3NH)2SO4=Fe(OH)SO4?(R3NH)2SO4 ⑷
试问:浸出液初始pH须加H2SO4调至0.9左右,pH>1.5时不利于萃取。试给出须加H2SO4的两个理由
![]() 。
。
![]() pH<0.5亦不利于萃取,给出其主要原因
pH<0.5亦不利于萃取,给出其主要原因 ![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com