
| A. | 形成尿酸钠晶体的反应为放热反应 | B. | 形成尿酸钠晶体的反应为吸热反应 | ||
| C. | 尿酸钠溶液呈酸性 | D. | 尿酸钠晶体一定难溶于水 |
分析 关节炎的病因主要是在关节滑液中形成了尿酸钠晶体,第一次关节炎发作往往在冬季,则温度越低,平衡Ur-+Na+?NaUr(s)正向移动,反应是可逆,尿酸钠晶体可溶于水,尿酸钠为强碱弱酸盐,其溶液呈碱性,以此来解答.
解答 解:A.第一次关节炎发作往往在冬季,则温度越低,平衡Ur-+Na+?NaUr(s)正向移动,所以正反应为放热反应,故A正确;
B.由A中分析可知,正反应为放热反应,故B错误,
C.尿酸钠为强碱弱酸盐,其水溶液呈碱性,故C错误;
D.关节炎的病因主要是在关节滑液中形成了尿酸钠晶体,反应是可逆,尿酸钠晶体可溶于水,故D错误;
故选A.
点评 本题以关节炎的病因为载体,考查温度对化学平衡移动的影响,难度不大,考查学生运用知识分析解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验中,温度计水银球应位于蒸馏烧瓶中液面以下 | |
| B. | 制备乙酸乙酯的实验中,导管末端要伸入饱和Na2CO3溶液液面下 | |
| C. | 分液操作中,待下层液体流出后,将上层液体从分液漏斗上口倒出 | |
| D. | 测定溶液pH时,可用pH试纸蘸取少量待测液并与标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含11个质子、12个中子、10个电子的粒子 | |
| B. | 含18个质子、22个中子、18个电子的粒子 | |
| C. | 含17个质子、18个中子、17个电子的粒子 | |
| D. | 含17个质子、20个中子、18个电子的粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中少量HCl气体:通过饱和NaHCO3溶液后再干燥气体 | |
| B. | 除去Na2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去氧化铝中混有的少量二氧化硅,用足量的稀盐酸溶解后过滤 | |
| D. | 除去FeCl3酸性溶液中少量的FeCl2:通入稍过量的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化钠溶液中加入足量硝酸银溶液:Ag++Cl-=AgCl↓ | |
| D. | 氯化铁溶液中加入氢氧化钠溶液:Fe3++3OH-=Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
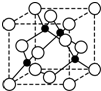 A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题:
A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题: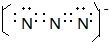 ;
;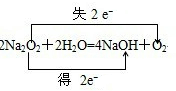 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不可能显碱性 | B. | 不可能显中性 | ||
| C. | 不可能显酸性 | D. | 可能中性、碱性、酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 | |
| B. | 麦芽糖和蔗糖互为同分异构体 | |
| C. | 淀粉遇碘化钾溶液变蓝 | |
| D. | 糖类不一定都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com