
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | | |

| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| 3 | | | 20 | 20 |
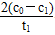
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量的K2SO4·Al2(SO4)3·24H2O代替实验①中的铁明矾,控制其他条件与实验①相同,进行对比实验 | 反应进行相同时间后,若溶液中c(Cr2O72—)大于实验①中的c(Cr2O72—)则假设一成立,若两溶液中的c(Cr2O72—)相同,则假设一不成立 |
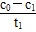 mol·L-1·min-1,由Δc(Cr3+)=2Δc(Cr2O72—)所以v(Cr3+)=
mol·L-1·min-1,由Δc(Cr3+)=2Δc(Cr2O72—)所以v(Cr3+)=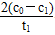 mol·L-1·min-1。(4)根据铁明矾组成离子可知,起催化作用的离子可能为Fe2+、Al3+、SO42—。(5)可通过在其他条件不变时,加入等物质的量的K2SO4·Al2(SO4)3·24H2O替代实验中的铁明矾,此时溶液中不存在Fe2+,但仍存在SO42—和Al3+,通过测定c(Cr2O72—)看是否仍然有催化效果来判断。
mol·L-1·min-1。(4)根据铁明矾组成离子可知,起催化作用的离子可能为Fe2+、Al3+、SO42—。(5)可通过在其他条件不变时,加入等物质的量的K2SO4·Al2(SO4)3·24H2O替代实验中的铁明矾,此时溶液中不存在Fe2+,但仍存在SO42—和Al3+,通过测定c(Cr2O72—)看是否仍然有催化效果来判断。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.全部 | B.①②⑤ | C.② | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.再加入30 mL 3 mol·L-1盐酸 |
| B.改用30 mL 6 mol·L-1盐酸 |
| C.改用3 g粉末状大理石 |
| D.适当升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g)
2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g) 2NH3(g);ΔH2<0反应速率为v2。
2NH3(g);ΔH2<0反应速率为v2。| A.同时增大 | B.同时减小 |
| C.v1增大,v2减小 | D.v1减小,v2增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 CH3COOC2H5+H2O
CH3COOC2H5+H2O
| 同一反应时间 | | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | | 6 | 93.0 | 100 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 △H<O,下列说法正确的( )。
△H<O,下列说法正确的( )。| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3是接触法制硫酸工艺中的重要反应,下列关于该反应的说法中错误的是
2SO3是接触法制硫酸工艺中的重要反应,下列关于该反应的说法中错误的是| A.增加SO2的浓度能加快该反应的速率 |
| B.通常使用铁作催化剂 |
| C.降低体系温度会减慢该反应的速率 |
| D.使用催化剂能改变该反应的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com