
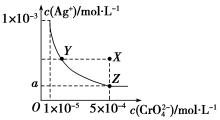
 图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.
图是铬酸银(Ag2CrO4)T℃时,在水溶液中的沉淀溶解平衡曲线.分析 (1)在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
(2)溶度积常数不变,依据溶液中Z点时离子浓度计算.
解答 解:(1)在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,
故答案为:不能;
(2)依据溶度积常数计算Ksp(Ag2CrO4)=c2(Ag+)•c(CrO42-)=1×10-11,Z点时c(CrO42-)=5×10-4,则c(Ag+)2=2×10-8,所以a=$\sqrt{2}$×10-4,
故答案为:$\sqrt{2}$×10-4.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,题目难度中等,明确难溶物溶度积的概念及表达式为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
| 实验 序号 | t/min C/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸的反应:2Fe+6H +═2Fe 3 ++3 H 2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO 3+2H +═Ca 2 ++2H 2O+CO 2↑ | |
| C. | 铜片插入硝酸银溶液:Cu+Ag +═Cu 2++Ag | |
| D. | 钠与水反应::2Na+2H 2O═2OH -+2Na ++H 2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温缩小体积,平衡向右移动,再次达平衡时颜色比原平衡浅 | |
| B. | 恒容升温,逆反应速率加快,正反应速率减慢 | |
| C. | 若改变条件使平衡向右移动,则该反应的平衡常数将增大 | |
| D. | 恒温恒容,充入少量NO2,再次达平衡时NO2的转化率比原平衡的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
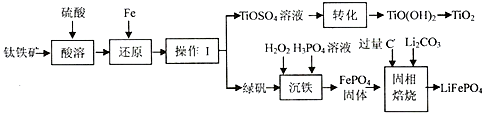
| 温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4(g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.
短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.| A. | 丙也可由W、Y组成的某种化合物与K直接反应制得 | |
| B. | K、L、M 中沸点最高的是M | |
| C. | 原子半径:W<X<Y | |
| D. | 元素的非金属性:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .下列能实现人工固氮的是D.
.下列能实现人工固氮的是D.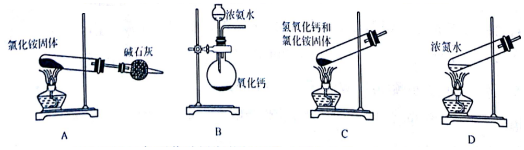
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:d>c | |
| B. | 单质的沸点:a<b | |
| C. | b、d的氧化物对应的水化物均为强酸 | |
| D. | b、c可形成离子化合物b3c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com