
1992年,我国取得重大科技成果之一就是发现了三种元素新的同位素,其中一种是 ,它的中子数为:
,它的中子数为:
A.80 B.288 C.208 D.128
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
工业上常用铁质容器盛装冷浓酸。铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除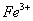 外还可能含有
外还可能含有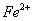 。若要确认其中的
。若要确认其中的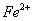 ,应选用 选填序号)。
,应选用 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性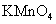 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
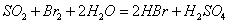 , 然后加入足量
, 然后加入足量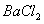 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中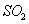 的体积分数为 。
的体积分数为 。
分析上述实验中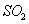 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有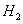 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
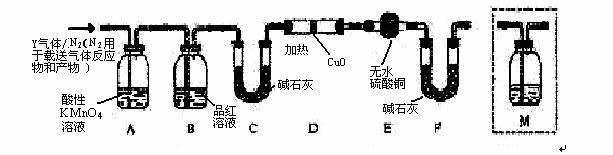
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有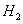 ,预计实验现象应是 。
,预计实验现象应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是
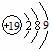 A.钾原子结构示意图: B.间羟基苯甲酸的结构简式:
A.钾原子结构示意图: B.间羟基苯甲酸的结构简式:
|
 D.Na2S的电子式:
D.Na2S的电子式: 查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白
作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。

(1)用图5所示装置制取Na2S2O3,其中NaOH溶液的作用是 ▲ 。如将分液漏斗中的H2SO4
改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 ▲ (填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反
应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式: ▲ 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 ▲ 作
指示剂,滴定终点的现象是 ▲ 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O3·5H2O的
质量分数会 ▲ (填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图6所示的装置可将工业级的Na2S提纯。已知Na2S
常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图6所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④趁热过滤;
⑤ ▲ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
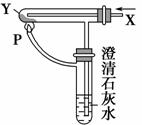
按右图装置通入X气体,并在管P处点燃,实验结果是澄清石灰水变浑浊,则X、Y可能是 ( )。
A.H2和Fe2O3
B.CO和CuO
C.H2 和Na2CO3
和Na2CO3
D.CO和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1molN2和3molH2,在一定条件下发生反应N2+3H2 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是:
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
C.达到化学平衡时,反应则停止进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—选修3 物体结构与性质】(15分)
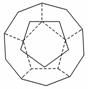 I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如右图。
I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如右图。
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理 :,顶点数+面数+棱边数=2,
请回答: C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为________,1 mol该分子中含有π键的数目为________。该分子中碳原子的杂化轨道类型是__________________,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在含CH3COOH和CH3COONa均为0.1mol/L的溶液中,测得pH<7,则下列说法中正确的是
A.c(CH3COO-)<c(Na+) B. c(CH3COOH) + c(CH3COO-)=0.2mol/L
C.c(CH3COOH) > c(CH3COO-) D.c(CH3COO-)>c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com