
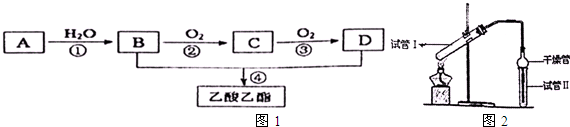
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、1mL 18mol?L-1浓硫酸 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 |
| C | 2mL乙醇、1mL乙酸 6mL 3mol?L-1 H2SO4 | 0.6 |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
 ;
; ,故答案为:
,故答案为: ;
;| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 6mL×3mol/L×2 |
| 6mL |
| 74×64.9% |
| 12 |
| 74×13.5% |
| 1 |
| 74-12×4-10 |
| 16 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液溶质物质的量浓度为1 mol/L |
| C、0.5 L 2 mol?L-1的BaCl2溶液中,Ba2+和Cl-的总数为3×6.02×1023 |
| D、10 g 98%的硫酸(密度为1.84 g?cm-3)与10 mL18.4 mol?L-1的硫酸的浓度不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| B、氧化铝溶解在NaOH溶液中:3H2O+Al2O3+2OH-?=2[Al(OH)4]-? |
| C、硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全Al3++SO42-?+Ba2++3OH-=BaSO4↓+Al(OH)3↓ |
| D、在漂白粉配制成的溶液中通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| R | T | |
| X | Y | Z |
| A、气态氢化物稳定性:Y>T |
| B、五种元素中原子半径最大的是Z |
| C、R位于元素周期表中第二周期第ⅣA族 |
| D、Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
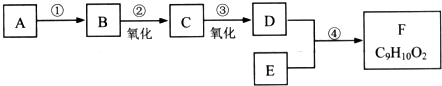
查看答案和解析>>
科目:高中化学 来源: 题型:
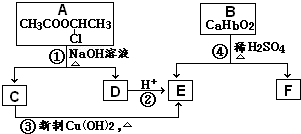 请根据如图作答:
请根据如图作答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将人群向低处疏散 |
| B、将人群向顺风向疏散 |
| C、用浸有水或弱碱性溶液的毛巾捂住口鼻 |
| D、向泄漏地点撒一些氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| R | ||
| X | Y | Z |
| A、X的氢化物比R的氢化物稳定 |
| B、原子半径大小顺序是Z>Y>X |
| C、X、Z可形成化合物XZ5,分子中各原子均满足最外层8电子结构 |
| D、Y、R形成化合物的化合物YR2能使KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com