
| A. | AgNO3 | B. | NaNO3 | C. | Mg(NO3)2 | D. | Al(NO3)3 |
分析 两串联电解池,左边放硫酸铜,右边放一定量的某硝酸盐溶液,电解时当左池有1.6gCu析出时,n(Cu)=$\frac{1.6g}{64g/mol}$=0.025mol,右池析出0.45g固体,说明该盐溶液中金属元素应该位于H之后,据此分析解答.
解答 解:两串联电解池,左边放硫酸铜,右边放一定量的某硝酸盐溶液,电解时当左池有1.6gCu析出时,n(Cu)=$\frac{1.6g}{64g/mol}$=0.025mol,右池析出0.45g固体,说明该盐溶液中金属元素应该位于H之后,这四个选项中只有Ag位于H之后,故选A.
点评 本题考查电解原理,为高频考点,明确离子放电顺序及金属活动性顺序表是解本题关键,也可以根据转移电子守恒进行计算,注意:如果关键转移电子守恒计算时,右池中阴极上除了生成金属单质外还可能有气体生成,为易错题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
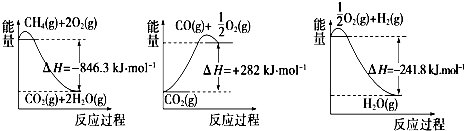
| 弱电解质 | H2CO3 | NH3•H2O |
| Ka1 | 4.30×10-7 | 1.77×10-5 |
| Ka2 | 5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
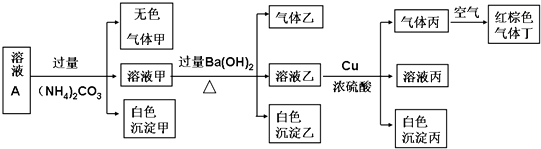
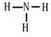
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②④⑤ | C. | ①③⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N4与N2互为同位素 | |
| B. | N4H44+与NaOH溶液反应的离子方程式为N4H44++4OH-═N4+4H2O | |
| C. | N4H4(SO4)2为弱电解质 | |
| D. | N4H44+中只含有极性共价键,不含非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg和Al | B. | Al和Fe | C. | Fe和Cu | D. | Na和Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.5g金属Zn与过量的硫酸反应,硫酸无论浓稀,转移电子数均为0.2Na | |
| B. | 含有1mol FeCl3的溶液中阴离子数等于3NA | |
| C. | 惰性电极电解食盐水,若线路中通过NA电子电量,则阳极产生气体11.2L | |
| D. | Na2S和Na2O2 固体混合物15.6g中,含有的阴离子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
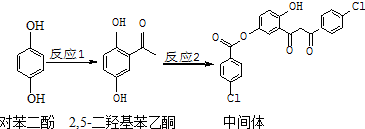
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27g铝与足量的盐酸或NaOH溶液反应,转移电子的数目均为3NA | |
| B. | 1mol的羟基与1mol的氢氧根离子所含电子数均为10NA | |
| C. | 22.4 L氨气中含有N-H键的个数为3NA | |
| D. | Fe与水蒸气在高温条件下反应,有1mol Fe参与反应,则转移电子的数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com