
已知合成氨反应的物质的量数据如下:
|
|
N2
+ 3H2 |
||
|
起始物质的量mol |
1.0 |
3.0 |
0 |
|
2秒末物质的量mol |
0.6 |
1.8 |
0.8 |
反应在2L容器中进行,当用氢气浓度的减少来表示该化学反应速率时,其速率为( )
A、0.2 mol/(L·s) B、0.3 mol/(L·s) C、0.6 mol/(L·s) D、0.8 mol/(L·s)
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
 a
a查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 高温高压 |
| 时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
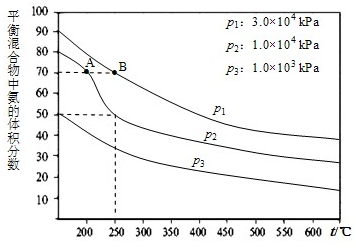 在工业合成尿素时常用NH3与CO2作原料进行生产.
在工业合成尿素时常用NH3与CO2作原料进行生产.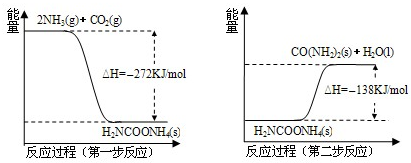
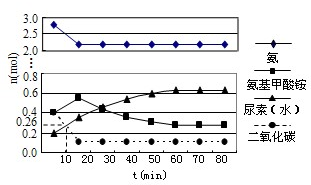
查看答案和解析>>
科目:高中化学 来源:2012-2013学年昆明三中、滇池中学高一下期中考试化学卷(滇中)(带解析) 题型:单选题
已知合成氨反应的物质的量数据如下:
| | N2 + 3H2  2NH3 2NH3 | ||
| 起始物质的量mol | 1.0 | 3.0 | 0 |
| 2秒末物质的量mol | 0.6 | 1.8 | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com