

| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
分析 含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物加入混酸加热过滤,铜反应生成铜盐溶液,Au、Pt不与混酸反应,所以滤渣的主要成分是Au、Pt,滤液1中的离子是Cu2+、Al3+、Fe2+,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝,
(1)Cu与混酸反应的实质是与H+、NO3-反应,随反应进行离子浓度逐渐减小,所以离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,3Cu+8H++2 NO3-=3Cu2++2NO↑+4H2O,Au、Pt不与混酸反应,所以滤渣的主要成分是Au、Pt,滤液1中的离子是Cu2+、Al3+、Fe2+;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调节溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
(4)甲方案不可行,因为滤渣2的主要成分是Fe(OH)3、Al(OH)3沉淀,加入硫酸沉淀全部溶解使制得的产品中含有较多Fe2(SO4)3杂质; 从原子利用率角度分析,乙方案更合理,不仅能除去硫酸铁,同时增加了硫酸铝的量,原子利用率较高
(5)由滴定反应方程式得100ml溶液中n(Cu2+)=b×10-3×a×5mol,所以CuSO4•5H2O质量分数=b×10-3×a×5×$\frac{250}{a}$×100%;
解答 解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以是滤渣;
故答案为:Cu+4H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2++2NO↑+4H2O,Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;使Fe3+、Al3+沉淀除去;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
故答案为:加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,
甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以从原子利用率和是否产生杂质考虑知,乙更合理,
故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;乙.
(5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
铜离子物质的量和标准液物质的量相同,则20mL溶液中铜离子的物质的量=cmol/L×b×10-3L=bc×10-3mol;
则ag样品中CuSO4•5H2O的质量=c×b×10-3mol×250g/mol×5,所以CuSO4•5H2O质量分数的表达式=$\frac{c×b×1{0}^{-3}×250×5}{a}$×100%.
故答案为:$\frac{c×b×1{0}^{-3}×250×5}{a}$×100%.
点评 本题考查离子分离的方法,实验设计,试剂选择,中和滴定的简单计算和误差的分析,离子性质的熟练掌握是解题关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 乙炔和甲苯 | B. | 丙烯和丙烷 | C. | 乙醇和丙酸 | D. | 甲醛与葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 | |
| B. | “硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | c(N2)/mol•L-1 | c(H2)/mol•L-1 | c(NH3)/mol•L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,560 mL甲烷与甲醛组成的混合物中含有的共用电子对数为0.1 NA | |
| B. | 电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜 | |
| C. | 2.24 LCO和2.8gN2组成的混合物中质子数为2.8 NA | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 →
→
 ,其核磁共振氢谱有2种峰.
,其核磁共振氢谱有2种峰. ,
,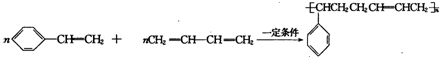 .
. (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{②Zn/H_{2}O}^{①O_{3}}$R-CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R-CHO+
 +H2O→R-COOH+HX
+H2O→R-COOH+HX
 、
、 ;
;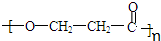 +nH2O.
+nH2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com