
| A. | ①>②>③>④>⑤ | B. | ⑤>④>③>②>① | C. | ①>②>④>③>⑤ | D. | ①>②>③>⑤>④ |
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: NH3•H2O+H+.
NH3•H2O+H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3 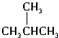 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH3 | |
| B. | CH3-CH3 CH2=CH-CH3 CH3CH=CHCH3 | |
| C. | 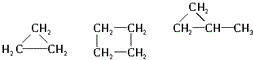 | |
| D. | CH3CH2CH2CH2CH3 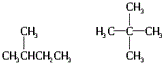 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑥ | C. | ②④⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
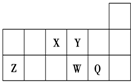
| A. | 元素X与元素Z的最高正化合价之和的数值等于8 | |
| B. | 原子半径的大小顺序为:Y>Z | |
| C. | 离子Y2-和Z3+的核外电子总数和电子层数都不相同 | |
| D. | 元素W的单质比Q的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
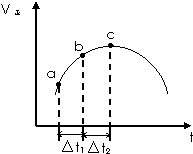 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 操 作 | 现 象 | 实 验 结 论 | |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 将某气体通入澄清石灰水中 | 变浑浊 | 该气体一定是CO2 |
| C | 向某溶液中加入2滴KSCN溶液; | 溶液不显红色; | 溶液中一定含有Fe2+ |
| 另取样,先滴入氯水,再滴入KSCN溶液 | 溶液变为红色 | ||
| D | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
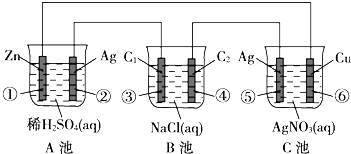 已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)
已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(其中C1、C2都为石墨电极)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.
某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com