
分析 根据n=$\frac{m}{M}$可知,质量相同时,摩尔质量越大,物质的量越小,则同温同压下体积与物质的量成正比;由pM=ρRT可知,密度与摩尔质量成正比;利用n=$\frac{m}{M}$结合分子的构成来计算原子数.
解答 解:设质量均为mg,
则物质的量分别为$\frac{m}{44}$mol、$\frac{m}{2}$mol、$\frac{m}{32}$mol、$\frac{m}{16}$mol、$\frac{m}{64}$mol,
同温同压下体积与物质的量成正比,则所占的体积由大到小的顺序是②④③①⑤;
含原子的物质的量分别为$\frac{m}{44}$×3mol、$\frac{m}{2}$×2mol、$\frac{m}{32}$×2mol、$\frac{m}{16}$×5mol、$\frac{m}{64}$×3mol,所含原子数由多到少的顺序为②④①③⑤;
由pM=ρRT可知,密度与摩尔质量成正比,即摩尔质量越大,密度越大,64>44>32>16>2,即密度由大到小的顺序为⑤①③④②,
故答案为:②④③①⑤;⑤①③④②;②④①③⑤.
点评 本题考查物质的量的简单计算,明确质量、物质的量的关系,熟悉常见物质的摩尔质量及相关计算公式即可解答.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制稀盐酸用量筒量取浓盐酸时,俯视刻度线 | |
| B. | 用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒2-3次,洗液倒入烧杯中 | |
| C. | 称量11.7 g NaCl配制0.2 mol/L NaCl溶液时,砝码错放在左盘 | |
| D. | 定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W | Q |
| 原子半径(nm) | 0.073 | 0.077 | 0.099 | 0.102 | 0.118 |
| 主要化合价 | -2 | +4、-4 | -1 | +6、-2 | +3 |
| A. | 单质沸点:W>Q>Z | |
| B. | W与Q形成的常见化合物可以稳定存在于水溶液中 | |
| C. | Z的含氧酸的酸性大于W的含氧酸的酸性 | |
| D. | X、Y、W三种元素两两之间均能以共价键形成AB2型的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
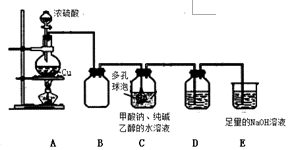 已知:①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O某小组进行如下实验:
已知:①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O某小组进行如下实验:| 假设 | 操作 | 现象 | 原理 |
| Na2S2O4 为强 碱弱酸盐,其溶 液为碱性. | 取少量溶液于试管中, 滴加紫色水蕊试液 | 溶液变 成蓝色 | S2O42-水解,使溶液成碱性 |
| Na2S2O4 中 S为+3 价,具有较强 的还原性. | 取少量溶液于试管中, 滴加过量新制氯水,再 滴加 BaCl2 溶 | 有白色沉淀生 成 | 该反应的离子方程式为:4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ ,Ba2++SO42-=BaSO4↓; |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 、
、 .
.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com