
| A. | 0.3molHNO3 | B. | 0.2molH3PO4 | ||
| C. | 3.01×1023个HNO3分子 | D. | 0.1molNH3 |
分析 0.3 molH2O含有0.6mol氢原子,有0.6NA个氢原子,0.3 mol HNO3中含有0.3NA个氢原子,0.2 mol H3PO4中含有的氢原子数为0.6NA个氢原子,3.01×1023个HNO3分子中含有0.1NA个氢原子,0.1molNH3中含有0.3NA个氢原子.
解答 解:A.0.3 mol H2O中含有0.6NA个氢原子,0.3 mol HNO3中含有0.3NA个氢原子,故A错误;
B.0.2 mol H3PO4中含有的氢原子数为0.6NA个氢原子,故B正确;
C.3.01×1023个HNO3分子中含有0.1NA个氢原子,故C错误;
D.0.1molNH3中含有0.3NA个氢原子,故D错误.
故选B.
点评 本题考查物质的量的计算,把握以物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 水解平衡正向移动 | B. | 各微粒浓度均变小(除H2O外) | ||
| C. | 溶液中离子数目增多 | D. | $\frac{c(N{a}^{+})}{c(C{O}_{3}^{2-})}$比值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+2HCl═FeCl2+H2↑ | |
| B. | 2HCl+Ca(ClO)2═2HClO+CaCl2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2↑ | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
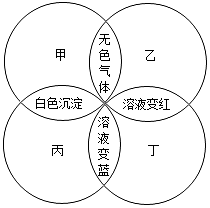 甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:
甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)
据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com