
mA(g)+nB(g)  pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是( )
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是( )
①体系的压强不再改变 ②绝热体系的温度不再改变 ③各组分的浓度不再改变
④各组分的质量分数不再改变 ⑤反应速率vA: vB: vC: vD = m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
| A.③④⑤⑥ | B.②③④⑥ | C.①③④⑤ | D.①③④⑥ |
B
解析试题分析:①若该反应是反应前后气体体积相等的反应,则无论反应是否达到平衡,体系的压强都不会改变。因此不能作为判断反应是否达到平衡的标志。错误。 ②任何反应发生的过程都伴随热量变化,若绝热体系的温度不再改变,则正向进行的程度与逆向进行的程度相同,反应达到平衡状态。因此可以作为判断反应达到偏高的标志。正确。③因为反应物、生成物的状态都是气态。若各组分的浓度不再改变,说明正反应速率与逆反应速率相同。反应达到平衡状态。正确。④各组分的质量分数不再改变 ,说明任何物质的物质的量不变,浓度不变,正反应速率与逆反应速率都相同,反应达到平衡状态。正确。⑤在任何时刻反应混合物中各物质的反应速率vA: vB: vC: vD =m:n:p:q。因此不能作为判断反应达到平衡状态的标志。错误。⑥单位时间内m mol A断键反应,就会有pmol的C键形成,同时p mol C也断键反应 ;即C的物质的量不变。由于反应混合物都是气态,所以任何物质的物质的量不变,因此反应达到平衡状态。正确。故 达到平衡的标志是②③④⑥。选项是B。
考点:考查化学平衡状态的判断的知识。


科目:高中化学 来源: 题型:单选题
运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快 |
| B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
| C.“纳米铜”与铜是同素异形体 |
| D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,将A、B、C三种物质各1 mol通入一个密闭容器中发生反应:2A+B 2C,达到化学反应限度时,B的物质的量可能是( )
2C,达到化学反应限度时,B的物质的量可能是( )
A.1.5 mol B.1 mol C.0.5 mol D.0
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:4NH3(g)+5O2(g) == 4NO(g)+6H2O(g) △H="-1" 025kJ/mol,该反应是一个可逆反应。若反应物 起始物质的量相同,下列关于该反应的示意图不正确的是( )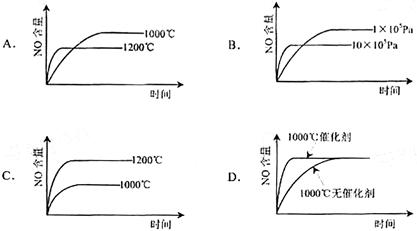
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在2L恒容密闭容器中充入2 mol X和lmol Y发生反应:2X(g)+Y(g) 3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
| A.升高温度,平衡常数增大 |
| B.W点X的正反应速率等于M点X的正反应速率 |
| C.Q点时,Y的转化率最大 |
| D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应:2NO2(g) 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是 ( )
| A.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加 |
| B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在恒容密闭器中通入物质的量浓度均0.1 mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g)  2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是 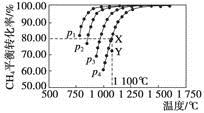
| A.上述反应的ΔH>0 |
| B.压强p1>p2>p3>p4 |
| C.1 100 ℃该反应的平衡常数为64 |
| D.压强为p4时,在Y点:v(正)<v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com