
| ���� | Mn��OH��2 | Co��OH��2 | Ni��OH��2 |
| Ksp | 2.1��10-13 | 3.0��10-16 | 5.0��10-16 |
| ���� | MnS | CoS | NiS |
| Ksp | 1.0��10-11 | 5.0��10-22 | 1.0��10-22 |
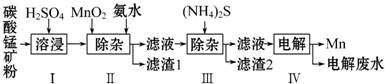
���� ��1����ϡ����ʱ��Ʒ�е�MnCO3�����ᷴӦ���ɿ����Ե�MnSO4��������������̼��ˮ��
��2���ݵ�ʧ�����غ���MnO2+2Fe2+--Mn2++2Fe3+���پݵ���غ���MnO2+2Fe2++4H+--Mn2++2Fe3+������ԭ���غ��MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O��
��3�������ڵ�һ�ι���֮�����Һ�к���Mn2+��Ni2+��Co2+�������м��루NH4��2S�����ݸ����ʵ��ܶȻ�������ȷ����CoS��NiS����������2�����ɣ�
��4�����ڵڶ��ι��˺����Һ����Ҫ����NiSO4��������ҺʱNi2+�������ϱ���ԭ��Mn2++2e-=Mn��
��� �⣺��1����ϡ����ʱ��Ʒ�е�MnCO3�����ᷴӦ���ɿ����Ե�MnSO4��������������̼��ˮ��������У�MnCO3�����ᷴӦ�Ļ�ѧ����ʽΪ��MnCO3+H2SO4=MnSO4+CO2��+H2O��
�ʴ�Ϊ��MnCO3+H2SO4=MnSO4+CO2��+H2O��
��2��������У�MnO2�����������¿ɽ�Fe2+��������ΪFe3+����Ӧ�����ӷ���ʽ�Ǿݵ�ʧ�����غ���MnO2+2Fe2+-Mn2++2Fe3+���پݵ���غ���MnO2+2Fe2++4H+-Mn2++2Fe3+������ԭ���غ�ã�MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O��
�ʴ�Ϊ��MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O��
��3�������ڵ�һ�ι���֮�����Һ�к���Mn2+��Ni2+��Co2+�������м��루NH4��2S�����ݸ����ʵ��ܶȻ�������ȷ����CoS��NiS����������2�����ɣ�
�ʴ�Ϊ��CoS��NiS��
��4�����ڵڶ��ι��˺����Һ����Ҫ����NiSO4��������ҺʱNi2+�������ϱ���ԭ��Mn2++2e-=Mn��
�ʴ�Ϊ������Mn2++2e-=Mn��
���� ���⿼�������ʷ�������̷����������ʣ������ᴿ���ʵ�ʵ����ƺͱ��ʷ���Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ƽ����Ҫԭ����NaCl��CO2��NH3 | |
| B�� | Na2CO3�����ȶ��Ե���NaHCO3 | |
| C�� | �÷����ĸ�������NH4Cl | |
| D�� | ĸҺ��ѭ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �϶�����I- | B�� | �϶���SO42- | C�� | �϶�����SO32- | D�� | �϶�����NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� | 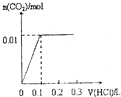 | C�� | 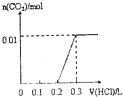 | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��H+��/c��OH-��=1012��ˮ��Һ�У�NH4+��Al3+��NO3- | |
| B�� | pH=1����Һ�У�Fe2+��NO3-��SO42- | |
| C�� | ˮ�������c��H+��=10-12mol/L����Һ�У�Ca2+��Cl-��HCO3- | |
| D�� | c ��Fe3+��=0.1mol/L����Һ�У�K+��SO42-��SCN- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����NA����ԭ�ӵĺ����ڱ�״���µ����ԼΪ11.2L | |
| B�� | 40 g NaOH�ܽ���1 Lˮ�У����Ƶõ���Һ�����ʵ���Ũ��Ϊ1 mol•L-1 | |
| C�� | ��״���£�11.2 L���Ȼ�̼����������Ϊ0.5NA | |
| D�� | ���³�ѹ�£�5.6g������������ᷴӦת�Ƶ�������Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ڢۢ� | C�� | �٢ܢ� | D�� | �ۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����������һ������ըҩ��������������������Ʒ�����ӽṹ��ͼ���뷢�����������Ƶã�����˵���в���ȷ���ǣ�������
����������һ������ըҩ��������������������Ʒ�����ӽṹ��ͼ���뷢�����������Ƶã�����˵���в���ȷ���ǣ�������| A�� | ������Ʒ��̼ԭ�Ӿ��ﵽ���ͽṹ | |
| B�� | ������Ʒ��һ�ȴ���ֻ��һ�� | |
| C�� | ������Ʒ�ķ���ʽΪC6H12N4 | |
| D�� | ������Ʒ���ӽṹ�к���3����Ԫ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com