
【题目】已知A是一种常见金属,试根据图中转化关系,回答下列问题:
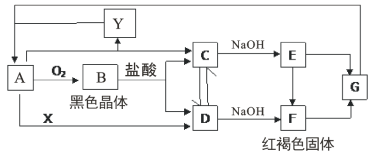
(1)写出B、G的化学式:B:___;G:___。
(2)检验D中阳离子的方法为___。
(3)保存C溶液时要加固体A的原因是___。
(4)写出E在空气中转化为F的化学方程式:___。
(5)取D的的溶液酸化后加入碘化钾淀粉溶液,产生的现象是___;相应的离子反应方程式为___。
【答案】Fe3O4 Fe2O3 取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+ 防止Fe2+被O2氧化 4Fe(OH)2+O2+2H2O=4Fe(OH)3 溶液变为蓝色 2Fe3++2I-=2Fe2++I2
【解析】
由图可知,A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3,X为Cl2,Y为H2。
(1)由图可知,B为Fe3O4,G为Fe2O3,故本题答案为:Fe3O4;Fe2O3;
(2)D为FeCl3,检验铁离子用KSCN溶液,方法是取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+,故本题答案为:取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+;
(3)C为FeCl2,保存FeCl2溶液时要加Fe,防止亚铁离子被氧气氧化为三价铁离子,故本题答案为:防止Fe2+被O2氧化;
(4)E为Fe(OH)2,F为Fe(OH)3,氢氧化亚铁在空气中不稳定,被氧气氧化成氢氧化铁,化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故本题答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)D为FeCl3,FeCl3的的溶液酸化后加入碘化钾淀粉溶液,会发生反应:2Fe3++2I-=2Fe2++I2,产生的碘单质可使淀粉变蓝,故本题答案为:溶液变为蓝色; 2Fe3++2I-=2Fe2++I2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有机物R是合成某药物的中间体,结构简式为![]() 。下列说法正确的是
。下列说法正确的是
A.R与M( )互为同分异构体B.R中所有碳原子一定处于同一平面
)互为同分异构体B.R中所有碳原子一定处于同一平面
C.R的六元环上的一氯代物有4种D.R能发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总化学方程式为2NO+O2+4CO 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。乙烯是石油化工最重要的基础原料,请根据以下框图回答:
![]()
(1)乙烯分子的空间结构为__;C官能团名称是___。
(2)与乙烯和氢气的加成产物互为同系物的是__(填写编号)。
a.C2H2 b.C6H6 c.C5H12 d.C2H6O
(3)A→B的化学方程式__。
(4)A+C→乙酸乙酯的化学方程式__;在该反应中,在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放__,其目的是__;实验室常用饱和碳酸钠溶液来收集乙酸乙酯其作用为__。
(5)“乙烯→A”的反应类型是___反应。下列物质在一定条件下都能与乙烯反应,其中反应类型与“乙烯→A”的不相同的是__(填序号)。
①氢气 ②氯化氢 ③氧气 ④溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的仪器选择和部分实验操作均正确的是( )
选项 | 实验 | 所选主要仪器铁架台等忽略 | 部分操作 |
A | 用浓硫酸配制480mL0.1mol/L硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将刚稀释所得的硫酸溶液立刻转移至500mL容量瓶,并加水至刻度线即可 |
B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量晶体出现时,停止加热,利用余热继续蒸干 |
C | 从碘的四氯化碳溶液中得到碘 | 蒸馏烧瓶、酒精灯、温度计、冷凝管、锥形瓶、牛角管 | 温度计水银球插入液液面以下 |
D | 用汽油提取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如图所示,关于实验操作或叙述错误的是 ( )
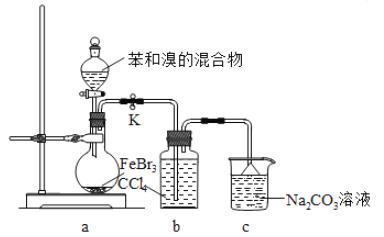
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
C. 实验中装置b中的液体逐渐变为浅红色
D. 装置c中的碳酸钠溶液的作用是吸收溴化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化学原料,在生产和生活中应用十分广泛。
是一种重要的化学原料,在生产和生活中应用十分广泛。
(1)氯水中![]() 具有漂白性,能杀菌消毒。其电子式为_____________。
具有漂白性,能杀菌消毒。其电子式为_____________。
(2)实验室可用![]() 和浓盐酸反应制取
和浓盐酸反应制取![]() ,反应的离子方程式是_________。
,反应的离子方程式是_________。
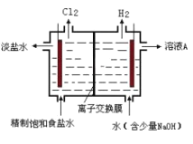
(3)工业上可采取电解饱和食盐水的方法制取![]() ,装置如图所示,图中的离子交换膜为_______(填“阳”或“阴”)离子交换膜。
,装置如图所示,图中的离子交换膜为_______(填“阳”或“阴”)离子交换膜。
(4)以![]() 为原料,用
为原料,用![]() 氧化制取
氧化制取![]() ,可提高效益,减少污染。反应如下:
,可提高效益,减少污染。反应如下:![]()
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使![]() 转化率接近100%,其基本原理如下图所示:
转化率接近100%,其基本原理如下图所示:
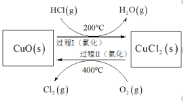
过程Ⅰ的反应为:![]()
![]()
①过程Ⅱ反应的热化学方程式为_______________。
②过程Ⅰ流出的气体通过稀![]() 溶液(含少量酚酞)进行检测,氯化初期主要为不含
溶液(含少量酚酞)进行检测,氯化初期主要为不含![]() 的气体,判断氯化结束时溶液的现象为___________。
的气体,判断氯化结束时溶液的现象为___________。
③相同条件下,若将氯化温度升高的300℃。溶液中出现上述现象的时间将缩短,其原因为______。
④实验测得在不同压强下,总反应的![]() 平衡转化率
平衡转化率![]() 随温度变化的曲线如图;
随温度变化的曲线如图;
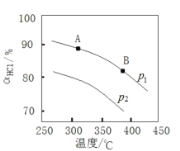
i 平衡常数比较:K(A)_________K(B)(填“>”“<”或“=”)。
ii 压强比较:p1_______p2 。(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和其他无机原料合成环状酯E和高分子化合物H的示意图如下所示:
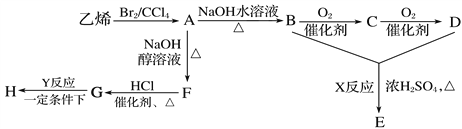
请回答下列问题:
(1)写出以下物质的结构简式:A______________,C_____________。
(2)写出以下物质的官能团名称:B__________,D_____________。
(3)写出以下反应的化学方程式:
A→B:______________________________________________________;
G→H:______________________________________________________。
(4)若环状酯E与NaOH水溶液共热,则发生反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应制得F、G两种高分子化合物,它们都是常用的塑料。

(1)F的结构简式为________。
(2)在一定条件下,两分子E能脱去两分子形成一种六元环状化合物,该化合物的结构简式为_______。
(3)①B→C 化学方程式为______。
②C与含有NaOH的Cu(OH)2悬浊液反应的化学方程式为______。
③E→G化学方程式为______。
(4)手性分子X为E的一种同分异构体,lmolX与足量金属钠反应产生lmol氢气,lmolX与足量银氨溶液反应能生成2molAg,则X的结构简式为_______。
(5)用G代替F制成一次性塑料餐盒的优点是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com