
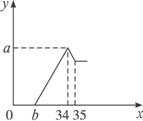
图3-7
(1)所用H2SO4的物质的量浓度为多少?
(2)若b=2.75 mL,则铝土矿中各组成成分的质量是多少?
思路解析:(1)此题与镁铝混合物先加酸再加碱的问题类似。由图可以看出当加进去的NaOH溶液体积为35 mL时沉淀的量最多,此时溶液与Na2SO4溶液中的H+量相等,因此
c(H2SO4)=![]() =1.75(mol·L-1)
=1.75(mol·L-1)
(2)b=2.75 mL时,因为Al2O3—Al3+—2Al(OH)3—2OH-—2![]() ,而溶解Al(OH)3所需的NaOH溶液为10 mL,所以样品中有Al2O3质量为:0.5×10 mol·L-1×
,而溶解Al(OH)3所需的NaOH溶液为10 mL,所以样品中有Al2O3质量为:0.5×10 mol·L-1×
Fe2O3质量为:10×0.002 25×1/6×160=0.6 (g)
SiO2的质量为:
答案:(1)所用H2SO4的物质的量浓度为1.75 mol·L-1。
(2)若b=2.75 mL,SiO2、Al2O3、Fe2O3的质量分别为:


科目:高中化学 来源: 题型:
 准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量和加入的NaOH溶液的体积(mL)如图所示.试回答下列问题:
准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量和加入的NaOH溶液的体积(mL)如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
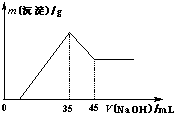 准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为( )
准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为( )查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)现有含Fe2O380%的赤铁矿100t,理论上可冶炼含Fe95%的生铁多少吨?
(1)现有含Fe2O380%的赤铁矿100t,理论上可冶炼含Fe95%的生铁多少吨?查看答案和解析>>
科目:高中化学 来源: 题型:
准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:

请填空回答:(1)H2SO4溶液的物质的量浓度为_________________。
(2)若a=2.3,用于沉淀Fe3+消耗NaOH的体积是____________mL,铝土矿中各组成分的质量分数:Al2O3为______________,Fe2O3为______________,SiO2为______________。
(3)a值的范围应是______________,在这个范围内,a值越大______________的质量分数越小。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com