
| A、△H1>△H2>△H3 |
| B、△H1<△H3<△H2 |
| C、△H2>△H1>△H3 |
| D、△H1>△H3>△H2 |
科目:高中化学 来源: 题型:
| A、向溶液中加入2滴KSCN溶液立即变红色 |
| B、向溶液中加入少许氯水后再加2滴KSCN溶液立即变红色 |
| C、向溶液中加入2滴KSCN溶液无明显变化,再加入少许氯水立即变红色 |
| D、向溶液中加入少许NaOH溶液立即产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NaX)>c(NaY)>c(NaZ) |
| B、c(NaZ)>c(NaY)>c(NaZ) |
| C、c(NaX)>c(NaZ)>c(NaY) |
| D、c(NaZ)>c(NaX)>c(NaY) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠和过氧化钡都是强氧化剂 |
| B、1 mol过氧化钠或过氧化钡跟足量水反应都生成0.5 mol氧气 |
| C、过氧化钡是离子化合物 |
| D、过氧化钡的化学式是Ba2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在使用过程中,电池正极区溶液的pH增大 |
| B、使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C、Zn是正极,Ag2O是负极 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、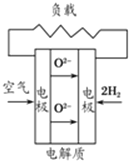 固化氧化物燃料电池 |
B、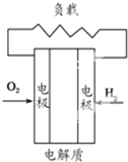 碱性氢氧燃料电池 |
C、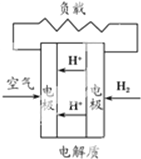 质子交换膜燃料电池 |
D、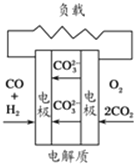 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石、石灰石、生石灰、CaCO3 |
| B、烧碱、纯碱、火碱、NaOH |
| C、熟石灰、消石灰、石灰乳、Ca(OH)2 |
| D、苏打、小苏打、纯碱、Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com