
【题目】电催化N2还原制NH3的一种反应机理如图所示,其中吸附在催化剂表面的物种用*表示,下列说法不正确的是

A.N2生成NH3是通过多步还原反应实现的
B.两个氮原子上的加氢过程同时进行
C.析氢反应(H*+H*→H2)会影响NH3的生成
D.NH3的及时脱附有利于增加催化剂活性位
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】将不同物质的量的M(g)和N(g)分别通入体积为2L的恒容密闭容器中,进行反应M(g)+N(g)![]() P(g)+Q(g),得到如下两组数据:
P(g)+Q(g),得到如下两组数据:

下列说法正确的是( )
A.将实验2的体积压缩为1L,c(Q)为0.4molL-1
B.温度升高,该反应的平衡常数增大
C.选择合适的催化剂可降低该反应的活化能,提高M的转化率
D.实验1中M的化学反应速率为0.32molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒电池以惰性材料做电解,在电解质溶液中发生的总反应式为:VO2+(蓝色)+H2O+V3+(紫色)![]() VO2+(黄色)+ V2+(绿色)+2H+,下列说法正确的是( )
VO2+(黄色)+ V2+(绿色)+2H+,下列说法正确的是( )
A.当电池放电时,VO2+离子被氧化
B.放电过程中,正极附近溶液的pH变大
C.充电时,阳极附近溶液由绿色逐渐变为紫色
D.放电时,负极反应为:VO2+ +2H+ +2e- =VO2+ +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,有机产物只有一种的是
A.乙醇与氧气在铜催化下的氧化反应
B.丙烯(CH3CH=CH2)与HBr的加成反应
C.甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用Al-PMOF可快速将芥子气降解为无毒物质,其结构如图。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法正确的是
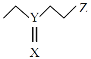
A.简单离子半径:Z>Y>XB.最简单氢化物稳定性:Z>Y>X
C.含氧酸酸性:Z>YD.YXZ2中Y的化合价为+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学环分解氯化铵的纯碱和氯乙烯集成清洁工艺如下:
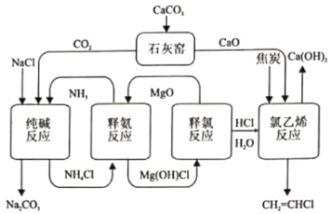
(1)“释氨反应”步骤可能发生的化学反应:
NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
则总反应NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=____kJ/mol
(2)“释氯反应”可能的化学反应有:
i. MgOHCl(s)≒MgO(s)+ HCl(g) ΔH=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)≒MgCl2(s)+H2O(g) ΔH=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ΔH=+94.61 kJ/mol
图为“释氯反应”在不同温度下各组分的平衡组成,回答下列问题
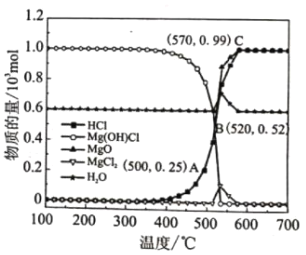
①应选择的最佳反应温度是___________
②500°C时,释氯反应器的压强为P,计算该温度下反应i的平衡常数Kp=___________ (Kp为以分压表示的平衡常数)
③结合平衡移动原理,原料气增加水蒸气的目的是___________
(3)“氯乙烯反应”中,![]() (g)+HCl(g)
(g)+HCl(g)![]() CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
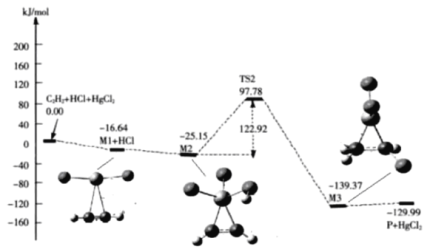
①碳碳叁键的键能:M1_____ ![]() (填“>”或“<”)
(填“>”或“<”)
②“M2→M3”的化学方程式为__________
③该反应的决速步骤为__________
(4)下列有关该工艺的说法不正确的是______(填标号)
A.可循环利用的物质有NH3、MgO、HCl
B.“石灰窑”和“纯碱反应”的副产物可实现资源化利用
C.利用MgO作为吸附剂可有效实现NH3与HCl分离
D.减少了从氯碱工业的产品获取HCl的电能消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.增大反应物浓度,可以增大单位体积的活化分子的百分数,使有效碰撞次数增大,反应速率加快
B.H2O2(l)=== ![]() O2(g)+H2O(l) △H=-98 kJ·mol-1,该反应在任何温度下均能自发进行
O2(g)+H2O(l) △H=-98 kJ·mol-1,该反应在任何温度下均能自发进行
C.有气体参加的反应,通入惰性气体,压强增大,从而反应速率加快
D.催化剂不影响反应的活化能,但能增大单位体积的活化分子百分数,加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是
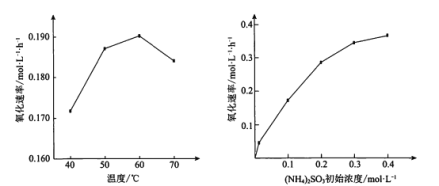
A.60℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与SO32-水解程度增大有关
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com