
据《读卖新闻》报道,日本海洋研究开发机构正在开发一项使用镍催化剂将二氧化碳转化成甲烷的新技术。实验室模拟该过程的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g),向一个固定容积为 2L 的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:CO2 0.2 molL-1,H2 0.8 mol·L-1,CH4 0.8 molL-1。下列说法不正确的是
CH4(g)+2H2O(g),向一个固定容积为 2L 的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:CO2 0.2 molL-1,H2 0.8 mol·L-1,CH4 0.8 molL-1。下列说法不正确的是
A.反应速率υ(H2)=0.16molL-1min-1
B.容器体积扩大为4L,平衡向逆反应方向移动
C.向体系中再充入1molH2,CO2的转化率增大
D.此条件下该可逆反应的平衡常数K=25
A
【解析】
试题分析:CH4的浓度的变为 0.8 molL-1,则H2的浓度改变了3.2molL-1,υ(H2)=3.2molL-1÷10min=0.32molL-1min-1,A错,选A;容器体积扩大为4L,相当于减小压强,反应向气体体积增大的方向移动,故平衡向逆反应方向移动,B 对,不选;向体系中再充入1molH2,平衡向正向移动,CO2的转化率增大,C对,不选;K=c(CH4) c2(H2O) /c(CO2) c4(H2)= (0.8×1.62)/( 0.2 ×0.84) =25,D对,不选。
考点:化学反应速率的计算、化学平衡的移动、化学平衡常数的计算。
考点分析: 考点1:化学平衡状态及移动 试题属性

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:选择题
有一种纸质软电池,采用薄层纸片作为载体和传导体,一面附着锌,另一面附着二氧化锰。电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),关于此电池,下列说法中正确的是
A.该电池Zn为负极,发生还原反应
B.该电池的正极反应为MnO2+e-+H2O=MnO(OH)+OH-
C.放电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时OH-通过薄层纸片向附着二氧化锰的电极移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:选择题
室温下,用0.1mol/L氨水分别滴定20.0mL、0.1mol/L的盐酸和醋酸,曲线如图所示,下列说法正确的

A.I曲线表示的是滴定盐酸的曲线
B.x=20
C.滴定过程中c(NH4+)/c(NH3·H2O)的值逐渐减小
D.当I曲线和II曲线pH均为7时,一溶液中的c(Cl-) 等于另一溶液中的c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三第一次模拟考试理科综合化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.人造纤维、合成纤维和光导纤维都是有机高分子化合物
B.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
C.明矾用于净水既与盐类的水解有关,又与胶体的眭质有关
D.棉花、羊毛及台成纤维完全燃烧都只生成二氧化碳和水
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:选择题
某溶液中可能含有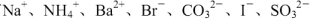 。某兴趣小组为确定该溶液的组成,进行了下列实验:取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无明显变化。下列说法正确的是
。某兴趣小组为确定该溶液的组成,进行了下列实验:取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无明显变化。下列说法正确的是
A.溶液中一定存在Na+、I-、CO32-
B.溶液中一定不存在的只有I-、SO32-
C.只需再进行一个实验,就可完全确定溶液的组成
D.溶液中一定存在Br-、CO32-,至少存在Na+、NH4+中的一种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关,下列说法正确的是
A.铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等
B.如果发生氯气泄漏,附近人员应迅速远离液氯泄漏地点,并顺风往低洼区域疏散
C.“低碳生活”倡导生活中尽量减少耗能,从而减少CO2排放
D.向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省泰安市高三下学期一模理科综合化学试卷(解析版) 题型:实验题
硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下:

回答下列问题:
(1)仪器A的名称为______,甲中活性炭的作用是______,B中加入的药品是______。实验时从仪器C中放出溶液的操作方法是________。
(2)装置丁中发生反应的离子方程式为___________。用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,下图中可选用的发生装置是________(填写字母)。

(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________,分离产物的方法是_________。
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_______。为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可)_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省江门市高三3月模拟考试理科综合化学试卷(解析版) 题型:选择题
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A.正极反应为Ag-e-=Ag+
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.当电路中转移0.1mol e-时,通过交换膜的阳离子为0.2mol
D.用KCl溶液代替盐酸,则电池总反应不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com