
1����֪2 mol����ȼ������Һ̬ˮʱ�ų�572kJ������
�� �÷�Ӧ�������������ܺ͡��� ������ڡ�����С�ڡ����ڡ�����Ӧ�������ܺ͡�
�� ��2mol������ȫȼ������ˮ��������ų������� ���������������������572 kJ��
��2����֪��C(s) + O2(g)  CO2(g) ��H����437.3 kJ•mol��1
CO2(g) ��H����437.3 kJ•mol��1
H2(g) + 1/2 O2(g)  H2O(g) ��H����285.8 kJ•mol��1
H2O(g) ��H����285.8 kJ•mol��1
CO(g) + 1/2 O2(g)  CO2(g) ��H����283.0 kJ•mol��1
CO2(g) ��H����283.0 kJ•mol��1
��ú��������Ҫ��Ӧ���Ȼ�ѧ����ʽ�ǣ�C(s) + H2O(g)  CO(g) + H2(g)
CO(g) + H2(g)
��H�� kJ•mol��1������÷�Ӧ��S����133.7 J��K��1��mol��1 �÷�Ӧ�ڳ������ܷ��Է����У� (��ܡ����ܡ�)��
 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ϩ�ǽ���ϳɵ�һ���л�����ķ��ӽṹ�ɼ�ʾΪ������C��Hԭ������ȥ�������й�����ϩ��˵���д�����ǣ� ��
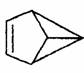 A����ϩ����ϩ��һ��ͬϵ��
A����ϩ����ϩ��һ��ͬϵ��
B����ϩ���������е�̼ԭ�Ӳ�������ͬһƽ����
C����ϩ�DZ���һ��ͬ���칹��
D. ��ϩ��һ�������¿��Է����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
COCl2 ��g�� CO��g��+ Cl2��g�� ��H>0,����Ӧ�ﵽƽ��ʱ�����д�ʩ�����¢ں���ͨ��������������CO��Ũ�� �ܼ�ѹ �ݼӴ��� ��ѹͨ��������壬�����COCl2ת���ʵ��ǣ� ��
CO��g��+ Cl2��g�� ��H>0,����Ӧ�ﵽƽ��ʱ�����д�ʩ�����¢ں���ͨ��������������CO��Ũ�� �ܼ�ѹ �ݼӴ��� ��ѹͨ��������壬�����COCl2ת���ʵ��ǣ� ��
A. �٢ڢ� B. �٢ܢ� C. �ڢۢ� D. �ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2 mol A��2 mol B�����2 L���ܱ������з�Ӧ��2A(g)��3B(g) 2C(g)��zD(g)
2C(g)��zD(g)
��2 s��A��ת����Ϊ50%�����v(D)��0.25 mol��L��1��s��1�������ƶ���ȷ���ǣ� ��
A��v(C)��0.2 mol��L��1��s��1 B��z��3
C��B��ת����Ϊ25% D��C���������Ϊ28.6%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
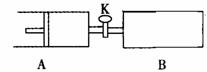 ��ͼ���رջ���K����A�г���1 molX��1 molY����B�г���2 molX��2 molY�� ��ʱA���ݻ���a L��B���ݻ���2aL������ͬ�¶Ⱥʹ������ڵ������£�ʹ�������и��Է���������Ӧ��X(g)+Y(g)
��ͼ���رջ���K����A�г���1 molX��1 molY����B�г���2 molX��2 molY�� ��ʱA���ݻ���a L��B���ݻ���2aL������ͬ�¶Ⱥʹ������ڵ������£�ʹ�������и��Է���������Ӧ��X(g)+Y(g)  2Z(g)+W(g)����H<0��A���ֺ�ѹ��B���ֺ��ݣ���ƽ��ʱ��A�����Ϊ1.4a L������˵��������ǣ� ��
2Z(g)+W(g)����H<0��A���ֺ�ѹ��B���ֺ��ݣ���ƽ��ʱ��A�����Ϊ1.4a L������˵��������ǣ� ��
A����Ӧ���ʣ�v(B)>v(A) �� B��A ������X��ת����Ϊ80%
C������K����A�������Ϊ2.6a L ����D��ƽ��ʱY�����������A<B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л�ѧ�����������ȷ����(����)��
A����ˮ�Լ��ԣ�NH3��H2O === NH4�� �� OH��
B������������Һ�����ԣ�NaHSO4 === Na�� �� H�� �� SO42��
C��Na2S��Һ�Լ��ԣ�S2�� �� 2H2O  H2S �� 2OH��
H2S �� 2OH��
D��AlCl3��Һ�����ԣ�Al3�� �� 3H2O Al(OH)3�� �� 3H��
Al(OH)3�� �� 3H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʱ����Ũ�Ⱥ�����ֱ�Ϊc1��v1��NaOH��Һ��c2��v2��CH3COOH��Һ���ϣ����й��ڸû����Һ�������������(����)��
A����pH>7ʱ����һ����c1v1=c2v2
B�����κ�����¶���c(Na+)+c(H��)=c(CH3COO��)+c(OH��)
C����pH=7ʱ����v1=v2����һ����c2>c1
D����v1=v2,c1=c2,��c(CH3COO��)+c(CH3COOH)=c(Na��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ڱ�״���£���������̬����ɵ�ij�������2.24 L��ȫȼ�պõ�4.48 L������̼��3.6 gˮ����������̬��������(����)��
A.CH4��C3H8 B��CH4��C3H4 C.C2H4��C3H4 D��C2H2��C2H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и��������ܹ�����������ǣ� ��
A. pH=0����Һ�У�Fe3+��Mg2+��Cl-��SO42-
B. ��������Ӧ������������Һ�У�K+��HC03-��Cl-��S2-
C. ʹpH��ֽ����ɫ����Һ�У�cu2+��Fe3+��N03-��SO42-
D����A1C13��Һ�У�Na+��[Al(OH)4]-��SO42- ��N03- ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com