
| A. | 2:1:2: | B. | 1:1:1 | C. | 2:2:1 | D. | 1:2:1 |
分析 ①2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,生成3molO2转移电子是12mol;
②2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,生成1molO2转移电子是4mol;
③2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,生成1molO2转移电子是2mol,以此计算.
解答 解:由①2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,生成3molO2转移电子是12mol;
②2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,生成1molO2转移电子是4mol;
③2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,生成1molO2转移电子是2mol,
若制得相同质量的O2,反应中上述各种物质的电子转移数目之比是4mol:4mol:2mol=2:2:1,
故选C.
点评 本题考查氧化还原反应及计算,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:多选题
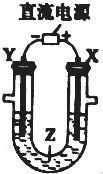
| A. | 氯碱工业中,X电极上反应式是4OH--4e-═2H2O+O2↑ | |
| B. | 电解精炼铜时,Z溶液中的Cu2+浓度变小 | |
| C. | 制取金属镁时,Z是熔融的氧化镁 | |
| D. | 在铁片上镀铜时,Y是纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、AlO2-、Cl-、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ca2+、Fe2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 取a克混合物充分加热至质量不变,减重b克 | |
| B. | 取a克混合物与足量稀硝酸充分反应,加热、蒸干、灼烧至熔化,冷却得b克固体 | |
| C. | 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰完全吸收,增重b克 | |
| D. | 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
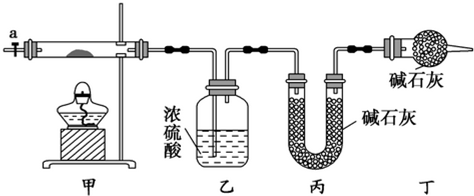

| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
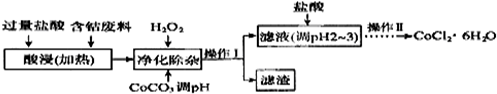
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)2 |
| 开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我们使用合金是因为它比纯金属具有更优良的化学性质 | |
| B. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 | |
| C. | 高分子材料可能在特殊情况导电,如聚乙炔 | |
| D. | 可用作荧光灯内壁保护层的纳米氧化铝属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、K+、NO3-、SO42- | B. | Al3+、Na+、HCO3-、SO42- | ||
| C. | NH4+、Al3+、NO3-、Cl- | D. | Na+、Cu2+、S2-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
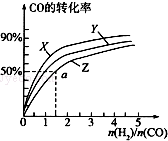 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子组成相差1个或若干个CH2原子团的物质互称为同系物 | |
| B. | 相对分子质量相同的有机物是同分异构体 | |
| C. | 分子式相同、结构相同的有机物物理性质和化学性质一定相同 | |
| D. | 碳原子之间只以单键相结合的链烃为烷烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com