
能用能量判据判断下列过程的方向的是( )
A.水总是自发地由高处往低处流
B.放热反应容易自发进行,吸热反应不能自发进行
C.有序排列的火柴散落时成为无序排列
D.多次洗牌以后,扑克牌的毫无规律的混乱排列的概率大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
现有失去标签的Ba(OH)2、MgCl2、H2SO4和Na2CO3四瓶溶液。为了确定这四种溶液成分,将他们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无现象 |
| ② | B+D | 有气体放出 |
| ③ | C+B | 有沉淀生成 |
| ④ | A+C | 有沉淀生成 |
根据上述实验填空:
(1)A、B、C、D四瓶溶液分别是(用化学式表示): 、 、 、
。
(2)写出B和C反应的离子方程式:_______________________________________________。
(3)写出一种非金属单质和B的浓溶液反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明醋酸是弱电解质的是
A.中和10mL 1mol/L CH3COOH溶液需要10ml 1mol/L NaOH溶液
B.用食醋可以除热水瓶内的水垢
C.pH=2的醋酸溶液稀释1000倍后pH小于5
D.用浓H2SO4和醋酸钠固体共热可制得醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
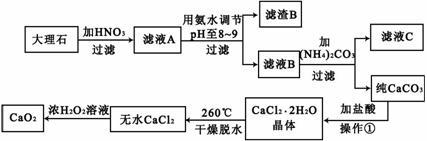
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,将x mL pH=a 的稀KOH溶液与ymL pH=b的稀硝酸充分反应。下列关于反
应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7 B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7 D.若x=10y,且a+b=14,则pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3===FeCO3↓+Na2SO4 FeCO3+C6H8O7===FeC6H6O7+CO2↑+H2O。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
(1)制备FeCO3时,选用的加料方式是________(填字母),原因是________ 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。
①铁粉的作用是________________。
②反应结束后,无需过滤,除去过量铁粉的方法是______________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
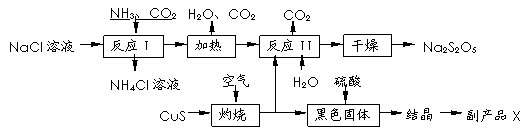 |
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)反应I的化学方程式为: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是 。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com