
|
如图是198 K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是
| |
| [ ] | |
A. |
该反应的热化学方程式为: N2+3H2 |
B. |
a曲线是加入催化剂时的能量变化曲线 |
C. |
加入催化剂,该化学反应的反应热也改变 |
D. |
在温度体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ则184>Q2>2Q1 |
科目:高中化学 来源: 题型:阅读理解
氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术
叫哈伯法,是德国人哈伯1905年发明的,其合成原理为:N2(g) + 3H2(g) ![]() 2NH3(g),△H=-92.4 kJ/mol,△S = -198.3J·mol-1·K-1。他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g),△H=-92.4 kJ/mol,△S = -198.3J·mol-1·K-1。他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
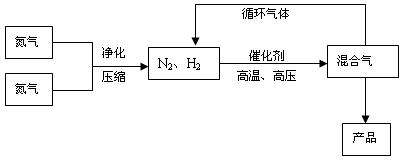
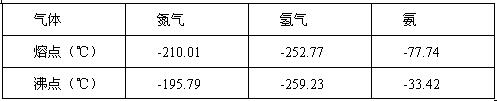
反应体系中各组分的部分性质见下表:
(1)下列说法正确的是
A. 因为△H= -92.4 kJ/mol,所以该反应一定能自发进行
B. 因为△S = -198.3J·mol-1·K-1所以该反应一定不能自发进行
C. 该反应在一定条件下可能自发进行。
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使混合气体分离出来产品;继续循环的气体是 。
(3)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积恒定,达到平衡时,气体的压强为原来的7/8,则N2的转化率а1= ,此时反应放热 kJ;
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2 а1(填“>、<或=”)。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)![]() 2NH3(g) 反应的影响。
2NH3(g) 反应的影响。
实验结果如图所示:(图中T表示温度,n表示物质的量)
① 图像中T2和T1的关系是:T2 T1,(填“高于”“低于”“等于”“无法确定”)
② 比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是 (填字母)。
③ 在起始体系中加入N2的物质的量为n/3mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。(不用写单位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com