
| A. | 第一电离能由大到小的顺序为N>O>C | |
| B. | 由于C22-和O22+为等电子体,所以可以判断O22+的电子式为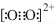 | |
| C. | NO3-中N采用sp2杂化,故NO3-的空间构型为三角锥形 | |
| D. | 液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
分析 A.同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
B.等电子体微粒结构相似;
C.计算N原子孤电子对数、价层电子对数,确定杂化方式与空间构型,孤电子对数=$\frac{1}{2}$(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子数,b为中心原子结合的原子最多能接受的电子数,而价层电子对数=σ键数目+孤电子对数;
D.态HF分子间存在氢键,HF缔合为(HF)n.
解答 解:A.同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,故A正确;
B.C22-和O22+为等电子体,等电子体微粒结构相似,所以可以判断O22+的电子式为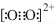 ,故B正确;
,故B正确;
C.N原子孤电子对数=$\frac{5+1-2×3}{2}$=0,价层电子对数=3+0=3,故NO3-的空间构型为平面正三角形,杂化轨道数目为3,N原子采用sp2杂化,故C错误;
D.液态HF分子间存在氢键,HF缔合为(HF)n,故D正确,
故选:C,
点评 本题考查电离能、等电子体、空间构型与杂化方式判断、氢键,注意同周期第一电离能异常情况.


科目:高中化学 来源: 题型:解答题
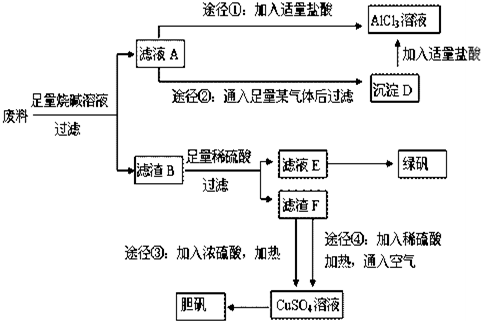
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙烷中含有6NA个共价键 | |
| B. | 1mol乙醇与足量乙酸在浓硫酸催化下反应可生成1mol乙酸乙酯 | |
| C. | 1mol某饱和醇(可看成是烷烃中的氢被羟基取代的产物)与足量的金属钠反应产生1molH2,说明其一个分子中含有两个羟基 | |
| D. | 1mol乙烯发生加成反应其断裂2mol共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨用作致冷剂 | B. | 明矾用作净水剂 | ||
| C. | 用氢氟酸刻蚀石英制艺术品 | D. | 用铁质容器盛放浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
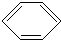 +Cl2
+Cl2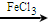
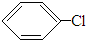 +HCl
+HCl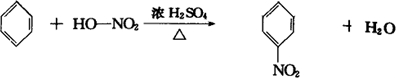
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com