
| A.为降低甲醛含量,新车应紧闭门窗,并放置加湿器 |
| B.发生“液氯泄漏”时,应疏导群众就近向地下室或地下建筑物转移 |
| C.“瓦斯”爆炸最猛烈时,煤矿坑道中甲烷的体积分数为33.3% |
| D.有朝一日宇航员乘坐“嫦娥”遨游月空时,在其轨道舱中无法完成“粗盐的提纯”实验 |
科目:高中化学 来源:不详 题型:单选题
| A.NaOH溶液 |
| B.Fe3+ |
| C.明矾 |
| D.Na2SO3和H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.提高汽油燃烧效率 | B.降低汽油成本 |
| C.避免铅污染大气 | D.防止铅与汽油反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (2)有人提议在一定的条件下使NO、CO两种气体反应转变为N2和CO2,其方程式可表示为:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-373.4kJ/mol.△S<0,又知该反应的平衡常数极大,常温下反应速率极小。
(2)有人提议在一定的条件下使NO、CO两种气体反应转变为N2和CO2,其方程式可表示为:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-373.4kJ/mol.△S<0,又知该反应的平衡常数极大,常温下反应速率极小。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Mg(OH)2+2HCl=MgCl2+2H2O | ||||
B.MgCl2
| ||||
C.2MgO
| ||||
| D.Mg2++2OH-=Mg(OH)2Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
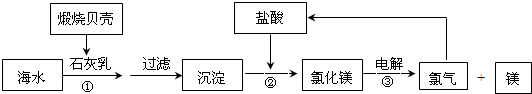
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
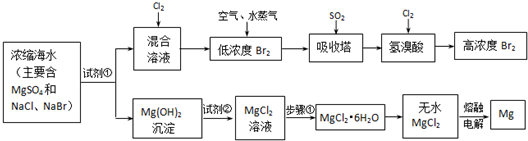
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com