
X、Y、Z、W、E为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高.E原子外围未成对电子数是同周期中最多的.W元素的电离能数据见下表(kJ•mol﹣1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
请回答:
(1)E元素基态原子的价电子排布式是: ,周期表中位置 ;
(2)X、Y、Z、W四种元素的电负性大小关系: (填元素符号,用“>”连接);
(3)写出W2Y2的电子式 ;
(4)X、Z可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;
(5)X的氢化物易溶于水的原因是:
(6)用氢键表示式写出Z的氢化物水溶液中可能存在的氢键 .
(7)肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N﹣H键断裂,则形成的π键有 mol.
考点:
位置结构性质的相互关系应用.
专题:
元素周期律与元素周期表专题.
分析:
X、Y、Z、W、E为前四周期五种元素,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高,则X为N、Y为O、Z为F;五元素分别位于周期表中三个紧邻的周期,则W处于第三周期,E处于第四周期,W的第二电离能剧增,说明W最外层电子数为1,故W为Na;E原子外围未成对电子数是同周期中最多的,则其外围电子排布为3d54s1,故E为Cr,据此解答.
解答:
解:依据分析可知:X为氮、Y为氧、Z为氟、W为钠、E为铬,
(1)E元素为Cr,Cr元素原子序数为24,Cr基态原子的价电子排布式是:3d54s1,处于周期表中第四周期第ⅥB族,故答案为:3d54s1;第四周期第ⅥB族;
(2)元素非金属性越强,其电负性越大,故N、O、F、Na四种元素的电负性大小关系为:F>O>N>Na,故答案为:F>O>N>Na;
(3)W2Y2为Na2O2,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为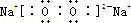 ,故答案为:
,故答案为: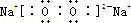 ;
;
(4)N、F可以形成一种共价化合物:NF3,NF3类似于NH3,氨气为三角锥形,则NF3分子的空间构型是:三角锥形,故答案为:三角锥形;
(5)氨气为极性分子,分子间存在氢键,且氨气与水分子间也能形成氢键,故氨气极易溶于水,故答案为:氨可与水形成分子间氢键、氨分子是极性分子;
(6)HF的水溶液中存在的氢键为:F﹣H…F F﹣H…O O﹣H…F O﹣H…O,故答案为:F﹣H…F F﹣H…O O﹣H…F O﹣H…O;
(7)有4mol N﹣H键断裂,即1molN2H4参加反应,生成1.5molN2,且1个N≡N中含2个π键,
则形成的π键有1.5mol×2=3mol,故答案为:3.
点评:
本题是对物质结构的考查,涉及电负性、核外电子排布、电子式、分子结构、氢键等,侧重对物质结构主干知识的考查,难度不大,注意理解电离能与原子结构、化合价的关系.


科目:高中化学 来源: 题型:
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用.下列实验中所选用的仪器合理的是( )
①用50mL量筒取5.2mL稀硫酸; ②用分液漏斗分离苯和四氯化碳的混合物;③用托盘天平称量11.7g氯化钠晶体;
④用碱式滴定管取23.10mL溴水; ⑤用瓷坩埚灼烧各种钠的化合物;⑥用250mL容量瓶配制250mL 0.2mol/L的NaOH溶液.
A. ①②④ B. ②③④⑥ C. ③⑥ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性.下列有关分析正确的是( )
|
| A. | K3C60中只有离子键 | B. | K3C60中不含共价键 |
|
| C. | 该晶体在熔融状态下能导电 | D. | C60与12C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种基态原子的电子排布式:①1s22s22p63s23p4,②1s22s22p63s23p3,③1s22s22p3,④1s22s22p5,下列比较中正确的是( )
|
| A. | 第一电离能:④>③>②>① | B. | 原子半径:④>③>②>① |
|
| C. | 电负性:④>③>①>② | D. | 最高正化合价:④>③=②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )

|
| A. | 正硼酸晶体中只存在氢键 |
|
| B. | H3BO3分子的稳定性与氢键无关 |
|
| C. | 分子中硼原子最外层为8e﹣稳定结构 |
|
| D. | 含1molH3BO3的晶体中有6mol氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列仪器能直接用酒精灯加热的是( )
①量筒 ②表面皿 ③烧杯 ④试管 ⑤烧瓶 ⑥蒸发皿 ⑦坩埚.
|
| A. | ②③④⑥⑦ | B. | ③④⑥⑦ | C. | ④⑥⑦ | D. | ③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 石灰水与过量碳酸氢钠溶液反应:HCO |
|
| B. | 向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O |
|
| C. | 氧化铜与稀硫酸反应:2H++O2﹣═H2O |
|
| D. | 碳酸氢钠溶液中加入盐酸:CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
36.5g HCl溶解在1L水中,所得溶液的密度为ρ g•mL﹣1,质量分数为w,物质的量浓度为cmol•L﹣1,NA表示阿伏加德罗常数,则下列叙述正确的是( )
|
| A. | 所得溶液的物质的量浓度:c=1mol•L﹣1 |
|
| B. | 所得溶液中含有NA个HCl分子 |
|
| C. | 36.5g HCl气体在标准状况下占有的体积约为22.4L |
|
| D. | 所得溶液的质量分数:w=36.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | ﹣4,+4 | ﹣2 | ﹣1,+7 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为 ;R在元素周期表中的位置是 .
(2)Z的单质与水反应的化学方程式是↑ .
(3)Y与R相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com