
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内消耗amolA和同时生成3amolC | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的总物质的量不再变化 |
分析 可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.
解答 解:A.C生成的速率与C分解的速率相等,说明反应到达平衡,故A正确;
B.单位时间内消耗amolA和同时生成3amolC,均表示正反应速率,反应始终按该比例关系进行,不能说明反应到达平衡,故B错误;
C.在体积可变容器内,一定温度下反应,容器内气体压强始终不变,故C错误;
D.随反应想混合气体的物质的量发生变化,当混合气体的总物质的量不再变化时,说明反应到达平衡,故D正确,
故选:AD.
点评 本题考查化学平衡状态判断,C选项为易错点,学生容易按恒温恒容条件判断,注意理解化学平衡状态的特征.


科目:高中化学 来源: 题型:解答题
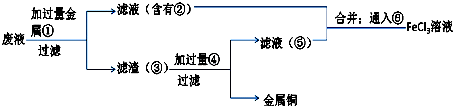
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 充电过程是电能转化为化学能的过程 | |
| C. | 放电时负极附近溶液的碱性不变 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
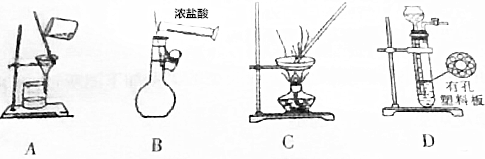
| A. | 用图a所示装置用除去淀粉溶液中的NaCl | |
| B. | 用图b所示装置配制100mL0.100mol•L-1稀盐酸 | |
| C. | 图c所示装置可用于从碘水中分离出I2 | |
| D. | 图d所示装置可用于CaCO3和稀盐酸制取少量的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属甲比金属乙容易失去电子,则甲比乙金属性强 | |
| B. | NaHCO3与NaOH反应有CO2生成 | |
| C. | 稀硝酸能将亚铁离子氧化为铁离子 | |
| D. | Na2CO3不能用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否含有氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据反应前后是否有元素化合价变化,可将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ②③ | D. | ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com